
【题目】将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
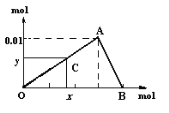
(1)OA曲线表示的离子反应是:__________________________;由此可得A点时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________,由此可得B点的坐标为:_______。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
【答案】Al3++3OH-=Al(OH)3↓ 10mL Al(OH)3+OH-=AlO2-+2H2O (0.04,0) 0.4 Al(OH)3、AlO2- 0.005mol、0.005mol
【解析】
根据图像,当从O点向A点运动时,表示随着氢氧化钠的不断加入,沉淀量逐渐增加,A点Al3+刚好完全沉淀,沉淀量达最大值;从A点到B点,随着氢氧化钠的不断加入,沉淀量逐渐减少,B点时Al(OH)3刚好完全溶解。根据原子守恒和相关方程式进行计算。
(1)当从O点向A点运动时,表示随着氢氧化钠的不断加入,沉淀量逐渐增加,因此OA曲线表示的离子反应是:Al3++3OH-=Al(OH)3↓。A点生成的氢氧化铝是0.01mol,则A点消耗的n(NaOH)=0.03mol,所以A点时加入氢氧化钠溶液的体积为为0.03mol÷3mol/L=0.01L=10mL。
(2)AB曲线表示Al(OH)3溶于NaOH,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。溶解0.01mol Al(OH)3消耗氢氧化钠0.01mol,由于之前已经消耗了0.03mol氢氧化钠,则B点的坐标为(0.04,0)。
(3)根据铝原子守恒可知n(AlCl3)=0.01mol,则c(AlCl3)=0.01mol÷0.025L=0.4mol/L,即AlCl3溶液中Al3+离子的浓度为0.4mol/L。
(4)当x=0.035时,加入氢氧化钠物质的量大于0.03mol(A点)小于0.04mol(B点),说明AlCl3完全沉淀后并溶解了部分Al(OH)3,铝元素在体系中的存在形式为Al(OH)3和AlO2-。加入0.03mol氢氧化钠时AlCl3完全沉淀生成0.01mol Al(OH)3沉淀,x=0.035mol时,溶解Al(OH)3消耗的氢氧化钠为0.035mol-0.03mol=0.005mol,根据离子反应Al(OH)3+OH-=AlO2-+2H2O可知0.005mol氢氧化钠溶解0.005mol Al(OH)3同时生成0.005molAlO2-,剩余的Al(OH)3为0.01mol-0.005mol=0.005mol;当x=0.035时,铝元素在体系中的存在形式为Al(OH)3和AlO2-,Al(OH)3和AlO2-物质的量都为0.005mol。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】在下列反应中,氧化产物与还原产物为同一物质的是
A. Cl2+2NaOH===NaCl+NaClO+H2O
B. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C. Fe+2HCl===FeCl2+H2↑
D. KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 某离子被沉淀完全是指该离子在溶液中的浓度变为0
B. 某物质的溶解性为难溶,则该物质的溶解度为0
C. 一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物
D. 沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
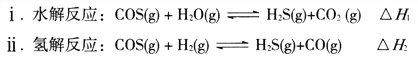
已知反应中相关的化学键键能数据如下表:
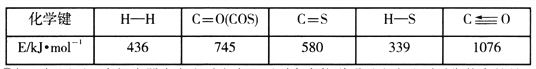
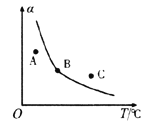
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
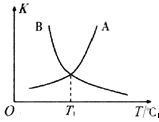
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为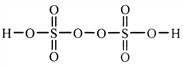
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不另用任何试剂就能将下列五种溶液:①CuCl2、②Na2SO4、③KCl、④K2CO3、⑤BaCl2鉴别出来,其正确的鉴别顺序是( )
A.①②④③⑤
B.④⑤③②①
C.①④⑤②③
D.①②④⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某气态平衡体系的平衡常数表达式为K=![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数K一定增大
B. 增大A浓度,平衡向正反应方向移动
C. 增大压强,C体积分数增加
D. 升高温度,若B的百分含量减少,则正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com