
【题目】在下列反应中,氧化产物与还原产物为同一物质的是
A. Cl2+2NaOH===NaCl+NaClO+H2O
B. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C. Fe+2HCl===FeCl2+H2↑
D. KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
【答案】D
【解析】
A项,该反应中Cl2发生歧化反应,对应还原产物为NaCl,对应氧化产物为NaClO,氧化产物与还原产物不是同一物质,故不选A项;
B项,该反应中Mn元素的化合价从+4价降低为+2价,对应的还原产物为MnCl2,Cl元素的化合价从-1价升高到0价,对应氧化产物为Cl2,氧化产物与还原产物不是同一物质,故不选B项;
C项,该反应中Fe元素的化合价从0价升高到+2价,对应氧化产物为FeCl2,H元素的化合价从+1价降低为0价,对应还原产物为H2,氧化产物与还原产物不是同一物质,故不选C项。
D项,该反应中KClO3中的Cl元素从+5价降低为0价,对应还原产物为Cl2,HCl中的Cl元素从-1价升高到0价,对应氧化产物为Cl2,氧化产物与还原产物为同一物质,故选D项。
综上所述,本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )

A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. 等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小
C. 等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3
D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体重50 kg的健康人含Fe元素约2 g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc,可使食物中的Fe3+转化为Fe2+。
①人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+做_______剂,过程B中Fe3+做______剂。
Fe3+的转化,在过程A中,Fe2+做_______剂,过程B中Fe3+做______剂。
②Vc使Fe3+转化为Fe2+,VC在这一过程中做___________,具有____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g·mL-1,质量分数为36.5 %的浓盐酸配制240mL0.1mol ·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240 mL 0.1mol·L-1的盐酸应量取浓盐酸体积________mL,应选用容量瓶的规格是________mL.
(3)所需的实验仪器除量筒和容量瓶外还有:________________。
(4)若配制的溶液浓度偏小,则可能的原因是________(填序号)。
①浓盐酸稀释溶解时有溶液溅出
②容量瓶洗净后没有干燥
③定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
④定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是:SO2 + H2O2 + BaCl2 ![]() BaSO4↓+ 2HCl。用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
BaSO4↓+ 2HCl。用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 0.1 mol BaCl2固体中所含离子总数为0.3 NA
B. 25 oC时,pH=1的HCl溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17 g H2O2中所含共用电子对数为2 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积为0.224 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
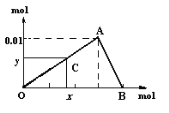
(1)OA曲线表示的离子反应是:__________________________;由此可得A点时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________,由此可得B点的坐标为:_______。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com