
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)
【答案】 +3 除去Cu2+、Fe3+ CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O 温度升高,盐酸挥发,反应物浓度降低 BiCl3+Na2CO3=BiOCl↓+2NaCl+CO2↑ 50∶1 5.3
【解析】(1)BiOCl中O为-2价,Cl为-1价,根据化合价代数和为0,可知Bi元素的化合价为+3价,答案为:+3
(2)向“酸浸”所得“浸液1”中加入Zn粉,Zn粉能与Cu2+、Fe3+反应生成Cu和Fe,从而除去Cu2+、Fe3+,答案为:除去Cu2+、Fe3+
(3) “浸铜”时,加入的物质是稀硫酸、MnO2,得到单质硫,发生反应CuS+MnO2+H+→Cu2++Mn2++S↓+H2O,根据化合价升降法配平,离子方程式为:CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,答案为:CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O
(4)“浸铋”时,所加物质为盐酸和氯化钠溶液,盐酸易挥发,升高温度,HCl挥发,反应物浓度降低,答案为:温度升高,盐酸挥发,反应物浓度降低
(5) “沉铋”时加入的物质是Na2CO3,生成BiOCl,因此有BiCl3+Na2CO3→BiOCl,根据发应特点产物还有NaCl和CO2,化学方程式为:BiCl3+Na2CO3=BiOCl↓+2NaCl+CO2↑答案为:BiCl3+Na2CO3=BiOCl↓+2NaCl+CO2↑
(6)①根据表格数据,L/S=50:1以后,Pb2+、As3+去除率虽然增加,但是Pb2+、As3+去除率变化都不大,因此为了节省能源以及原料,L/S控制在50:1②c(AsO43-)=1×10-9mol/L,此时c(Fe3+)=Ksp(FeAsO4)/c(AsO43-)=5×10-21/10-9mol/L=5×10-12mol/L,此时c(OH-)=![]() =
=![]() =2×10-9 mol/L,此时的pH=5.3,即pH小于5.3.答案为:5.3
=2×10-9 mol/L,此时的pH=5.3,即pH小于5.3.答案为:5.3


科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( )
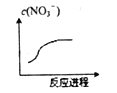
A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4==H++HSO4-,HSO4-![]() H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)Na2SO4溶液呈_______(填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为____________________________________。
(3)在:0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____(填字母)
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO42-)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO42-)___(填“<”“>”或“=”)0.029mol/L
(5)若25℃时,0.10mol/LH2SO4溶液的pH=-lg0.11,则0.10mol/LH2SO4溶液中c(SO42-)=____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:
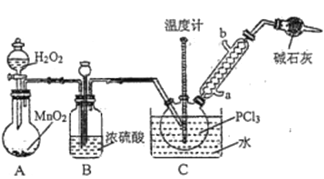
已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)POCl3遇水反应的化学方程式为_________________________________________。
(2)装置B的作用除干燥O2外,还有_________________________________________。干燥管的作用是_______________。
(3)反应温度要控制在60~65℃,原因是_____________________________________________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol/LAgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2mol/LKSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(4)步骤③中加入硝基苯的作用是___________________________________________。若无此操作,所测产品中氯元素的质量分数将会__________(填“偏大”、“偏小”或“不变”)。
(5)步骤④中X为__________,产品中POCl3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
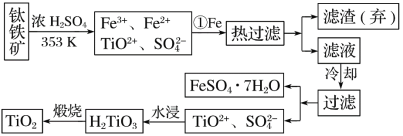
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块镁铝合金,其中镁与铝的质量比是8∶9。加入200mL稀HNO3使其恰好完全溶解,产生NO气体在标准状况下的体积为3.36L,然后向溶液中再加入NaOH溶液至沉淀质量不再发生变化,过滤、洗涤、干燥、称量。
(1)合金中铝的物质的量为_________,最后所得沉淀的质量为_________。
(2)另取200 mL原稀HNO3和300 mL稀硫酸组成混合液,向其中加铜粉使之充分反应,得到只含一种溶质的溶液,求所加稀硫酸的物质的量浓度。(无解题过程不给分)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,氧化产物与还原产物为同一物质的是
A. Cl2+2NaOH===NaCl+NaClO+H2O
B. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C. Fe+2HCl===FeCl2+H2↑
D. KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设pC为溶液中粒子物质的量浓度的负对数,即:pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是
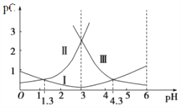
A. 曲线I表明,c(R2-)随着pH增大而逐渐增大
B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L
C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000
D. NaHR水溶液中:c(Na+)>c(HR-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
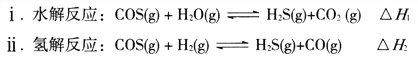
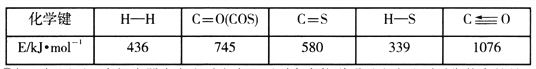
已知反应中相关的化学键键能数据如下表:
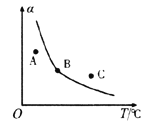
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
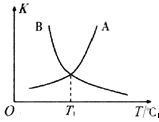
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为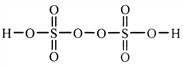
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com