
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4==H++HSO4-,HSO4-![]() H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)Na2SO4溶液呈_______(填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为____________________________________。
(3)在:0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____(填字母)
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO42-)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO42-)___(填“<”“>”或“=”)0.029mol/L
(5)若25℃时,0.10mol/LH2SO4溶液的pH=-lg0.11,则0.10mol/LH2SO4溶液中c(SO42-)=____mol/L。
【答案】 弱碱性 SO42-+H2O![]() HSO4-+OH- Ba2++HSO4-===BaSO4↓+H+ BCD <(H2SO4溶液中存在:H2SO4===HSO4-+H+,电离出的H+抑制HSO4-的电离) 0.01
HSO4-+OH- Ba2++HSO4-===BaSO4↓+H+ BCD <(H2SO4溶液中存在:H2SO4===HSO4-+H+,电离出的H+抑制HSO4-的电离) 0.01
【解析】
(1)根据硫酸的第一步电离是完全的H2SO4==H++HSO4-,第二步电离是不完全的,HSO4-![]() H++SO42-,可以将SO42-看成弱根离子,Na2SO4溶液中SO42-发生水解:SO42- +H2O
H++SO42-,可以将SO42-看成弱根离子,Na2SO4溶液中SO42-发生水解:SO42- +H2O![]() OH-+ HSO4-
OH-+ HSO4-
所以,溶液呈弱碱性。本题正确答案:(1). 弱碱性 SO42-+H2O![]() HSO4-+OH-
HSO4-+OH-
(2)H2SO4溶液与BaCl2溶液反应离子方程式为. Ba2++HSO4-===BaSO4↓+H+
(3)B为质子守恒;C为电荷守恒;D为物料守恒;所以答案是:BCD
(4)<;H2SO4=HSO4-+H+,电离出的H+抑制HSO4-的电离
(5)0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则c(H+)=0.11mol·L-1,硫酸一级电离出c(H+)为0.1mol·L-1,因此0.11-0.1=0.01,多电离出的H+为二级电离所得,即C(SO42-)=0.01mol·L-1。所以本题答案; 0.01


科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
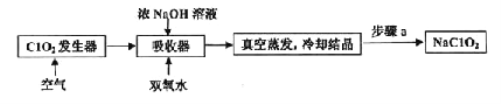
A. 通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B. 吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C. 步骤a的操作包括过滤、洗涤和干燥
D. 工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
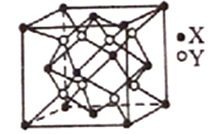
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
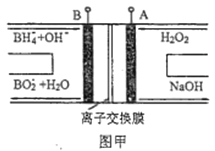
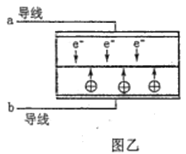
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)是无色透明有水果香气的液体,俗称安息香酸乙酯,常用做溶剂和香料。下列说法正确的是( )
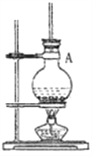
A. 按如图装置制备苯甲酸乙酯,应在烧瓶A中先加入3mL浓H2SO4和4g苯甲酸,然后边振荡烧瓶边慢慢加入10mL乙醇
B. 如图是制备苯甲酸乙酯的简易装置,A中玻璃导管改用球形玲凝管效果更好
C. 制得的苯甲酸乙酯粗产品,可通过水洗、NaOH溶液洗涤、水洗,除去苯甲酸乙酯中的部分杂质
D. 分子式为C9H10O2,含有苯环且能与饱和NaHCO3溶液反应放出气体的有机物共有15种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )

A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. 等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小
C. 等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3
D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是:SO2 + H2O2 + BaCl2 ![]() BaSO4↓+ 2HCl。用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
BaSO4↓+ 2HCl。用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 0.1 mol BaCl2固体中所含离子总数为0.3 NA
B. 25 oC时,pH=1的HCl溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17 g H2O2中所含共用电子对数为2 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积为0.224 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com