
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
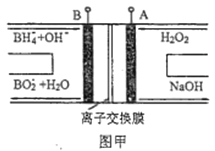
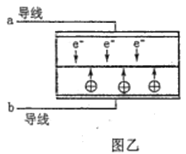
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
【答案】C
【解析】A.电池放电过程中, 负极发生氧化反应生成BO2,电极反应式为BH4+8OH8e= BO2+6H2O,A电极为正极,正极电极反应式为H2O2+2e-=2OH-,为维持电荷平衡,应选用阳离子交换膜,原电池中阳离子移向正极,Na+从负极区向正极区移动,故A正确; B.根据图片知,双氧水得电子发生还原反应,则A电极为正极,正极电极反应式为H2O2+2e-=2OH-,故B正确;C.负极发生氧化反应生成BO2,电极反应式为BH4+8OH8e= BO2+6H2O,有1molNaBH4参加反应转移电子数为:8NA,故C错误;D. 要使LED发光二极管正常发光,图乙中的导线a阴极应与图甲中的B极负极相连,故D正确。答案选C.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)![]() LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
A. 重新达到新平衡时H2的压强仍然为2Mpa
B. 当LaNi5的浓度不再变化时,表明达到平衡状态
C. 扩大容器体积,重新达到平衡时n(H2)增多
D. 增大压强。降低温度,有利于储氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4==H++HSO4-,HSO4-![]() H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)Na2SO4溶液呈_______(填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为____________________________________。
(3)在:0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____(填字母)
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO42-)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO42-)___(填“<”“>”或“=”)0.029mol/L
(5)若25℃时,0.10mol/LH2SO4溶液的pH=-lg0.11,则0.10mol/LH2SO4溶液中c(SO42-)=____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si+4HCl。
Si+4HCl。
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ②为化合反应
C. ①②③均为氧化还原反应
D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
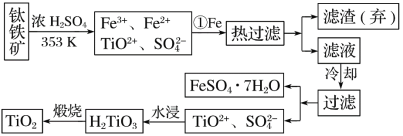
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SiO4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子排布图是____________________。
②写出与SiO4-具有相同空间构型和键合形式的微粒,分子和离子各写一个_______。
③下图为一种硅氧组群的结构示意图,其离子符号为____,其中Si原子的杂化方式为_____。
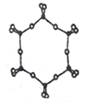
④电负性:Si____O(填“>”、“=”或“<”) 。
(2)2017年,我国科学家又在碳原子研究上获得突破:由中科院大学物理学院苏刚教授等人通过理论计算预言的一种三维碳结构T-碳(T-carbon) 诞生,中外科学家联合研究团队成功合成了T-碳,从而使T-碳成为可与石墨和金刚石比肩的碳的另一种三维新结构。T碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。T-碳属于_____晶体。已知T-碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为_______g/cm3。(写出表达式即可)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com