
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。
【答案】Cl2O、ClO2 Cl2O7+H2O=2H++2ClO4﹣ 氧化 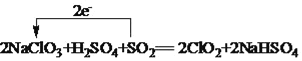 AC 0.1NA
AC 0.1NA
【解析】
(1)根据三种氧化物的沸点分析;
(2)Cl2O7属于酸性氧化物,它与水反应生成高氯酸,据此解答;
(3)根据ClO2可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去分析判断;
(4)根据反应中Cl、S元素的化合价变化结合电子得失守恒分析判断;
(5)根据反应中氯元素的化合价变化以及还有氯化钠生成分析判断。
(1)常温下,沸点低于25℃的为气体,则结合表格中的数据可知Cl2O、ClO2为气体;
(2)Cl2O7属于酸性氧化物,与水反应生成HClO4,离子方程式为Cl2O7+H2O=2H++2ClO4-;
(3)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,反应中Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性;
(4)反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4中NaClO3中Cl元素由+5价降低到+4价,二氧化硫中S元素化合价由+4价升高到+6价,转移电子数为2e-,则用单线桥法表示该反应电子转移的方向和数目为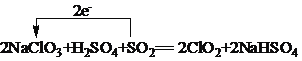 ;
;
(5)①HCl中的氯元素化合价从-1价升高到0价,氯酸钠中氯元素化合价从+5价降低到+4价,则氯化氢中氯元素被氧化,HCl作还原剂,同时还有NaC生成,故HCl还起酸的作用,答案为AC;
②根据反应2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl可知NaClO3中Cl元素由+5价降低到+4价的ClO2,所以产生0.1molClO2,则转移的电子数为0.1NA。


科目:高中化学 来源: 题型:
【题目】下图是实验室制备1,2一二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
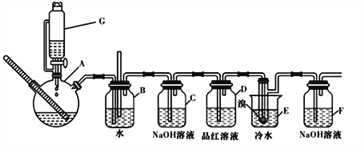
有关数据列表如下:

请按要求回答下列问题:
已知:CH3CH2OH![]() CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
(1)G中药品为1:3无水乙醇和浓硫酸混合液,用来制备乙烯,装置G的名称为_____
(2)装置B中长直导管的作用是_____________
(3)反应过程中应用冷水冷却装置E中大试管,但又不能过度冷却(如用冰水),其原因是_____
(4)某学生发现反应结束时,G中试剂消耗量大大超过理论值(装置不漏气),其原因是_____(任写出一种可能的原因)
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是______
(6)若消耗无水乙醇的体积为100 mL,制得1,2一二溴乙烷的体积为40 mL,则该反应的产率为___(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中反应物总能量小于生成物总能量的是( )
A.钠和水的反应
B.炭与水蒸气制水煤气的反应
C.盐酸与氢氧化钠溶液的反应
D.铝在氧气中燃烧的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
(1)氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”);理由是_____。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)
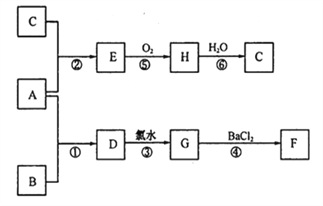
则:①A和B 分别为:A_________ B_________;
②A与B发生反应的条件是__________________;
③反应⑥的化学方程式为_____________________;
④上述反应中,不属于氧化还原反应的是_______________。(填数字序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
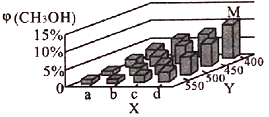
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
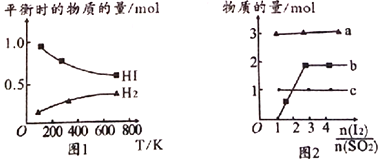
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
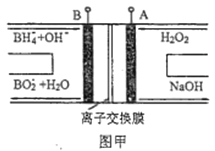
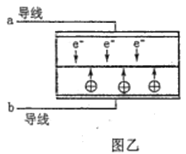
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com