
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
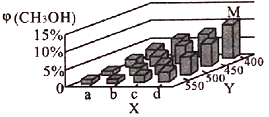
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
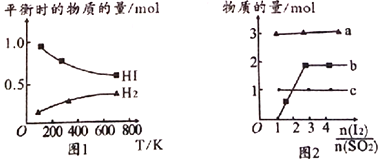
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
【答案】 -12 25% 小 随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度 4000 < 2H+ I3- 减小
CH3OH(g)向逆反应方向进行,故Y为温度 4000 < 2H+ I3- 减小![]() 的投料比
的投料比
【解析】分析:(1)根据“反应热=反应物总键能-生成物总键能”计算;
(2)①可设CO的转化率为α,根据化学方程式及已知数据列三段式计算;②由CO(g)+2H2(g)![]() CH3OH(g) △H<0可得,增大压强平衡正向移动,升高温度平衡逆向移动;
CH3OH(g) △H<0可得,增大压强平衡正向移动,升高温度平衡逆向移动;
(3)根据K=![]() =
=![]() 计算;
计算;
(4)①根据图1,分解HI时HI与H2在平衡时的物质的量随温度的变化,判断温度对平衡移动的影响;②由二氧化硫通入碘水中发生的两个反应可得:I2过量时,I-减小,I3-增多,且![]() 越大,I-会越小,I3-会越多;H+和HSO4-都不变,且n(H+):n(HSO4-)=3:1,再结合图2分析即可。
越大,I-会越小,I3-会越多;H+和HSO4-都不变,且n(H+):n(HSO4-)=3:1,再结合图2分析即可。
详解:(1)设C-H键能为x kJmol-1,△H =反应物总键能-生成物总键能=3x kJmol-1+351 kJmol-1+463 kJmol-1+3×393 kJmol-1-(3x kJmol-1+293 kJmol-1+2×393 kJmol-1+2×463 kJmol-1)=-12 kJmol-1。
(2)①设CO的转化率为α,CO和H2的初始物质的量分别为l mol、2 mol,则CO反应了α mol,由化学方程式列三段式可得:
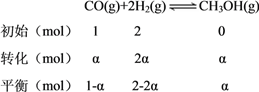 ,因为CH3OH(g)的体积分数=CH3OH(g)的物质的量分数,平衡时,M点CH3OH的体积分数为10%,则
,因为CH3OH(g)的体积分数=CH3OH(g)的物质的量分数,平衡时,M点CH3OH的体积分数为10%,则![]() ×100%=10%,解得:α=25%。
×100%=10%,解得:α=25%。
②根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡“CO(g)+2H2(g)![]() CH3OH(g) △H<0”向逆反应方向进行,故Y表示温度。
CH3OH(g) △H<0”向逆反应方向进行,故Y表示温度。
(3)由已知,发生反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的溶液为PbCl2和PbI2的饱和溶液,所以K=
PbI2(s)+2Cl-(aq)的溶液为PbCl2和PbI2的饱和溶液,所以K=![]() =
=![]()
![]() =
=![]() =4000。
=4000。
(4)①由图1可知,平衡时随温度的升高,HI减小,H2增大,则反应2HI(g)![]() H2(g)+I2(g)正向吸热,说明反应H2(g)+I2(g)
H2(g)+I2(g)正向吸热,说明反应H2(g)+I2(g)![]() 2HI(g)正向放热,故△H<0。
2HI(g)正向放热,故△H<0。
②根据图2,b为从零逐渐增大的离子,a和c始终不变,且a、c物质的量之比为3:1,则根据SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,反应中I3-越来越多,H+和HSO4-始终不变,且n(H+):n(HSO4-)=3:1,所以a为H+,b为I3-,由图2知
I3-,反应中I3-越来越多,H+和HSO4-始终不变,且n(H+):n(HSO4-)=3:1,所以a为H+,b为I3-,由图2知![]() 增大,I3-越多,则I-会越小,所以要提高碘的还原率,除控制温度外,还可以减小
增大,I3-越多,则I-会越小,所以要提高碘的还原率,除控制温度外,还可以减小![]() 的投料比。
的投料比。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是()
A.SO2能使品红溶液褪色,说明SO2具有漂白性
B.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
C.用HF来刻蚀玻璃,说明SiO2是碱性氧化物
D.雨水显酸性是因为吸收了空气中的CO2,pH小于1的雨水称为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si+4HCl。
Si+4HCl。
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ②为化合反应
C. ①②③均为氧化还原反应
D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是
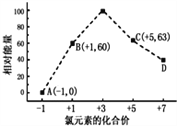
A. ClO2-→ClO3-+ClO4- 可以自发进行
B. A、B、C、D中C最稳定
C. B→A+D反应的活化能为60 kJmol-1
D. B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H= -117 kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com