
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
【答案】 B 反应i为吸热反应,升高温度,平衡正向移动,CHOH(g)的平衡转化率增大 9:5 减小 升高温度。反应i中CO的物质的量增大。反应ii中CO的物质的量增大、CO2的物质的量减小,最终n(CO2)/(CO)的值减小 P1>P2>P3 0.875
【解析】(1)反应iCH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1为吸热反应,升高温度,平衡正向移动,CHOH(g)的平衡转化率增大,B曲线正确;由图1可知,T1℃时,CH3OH(g)的平衡转化率为40%,则平衡体系中CH3OH(g)、CO(g)、H2的物质的量分别为0.6mol、0.4mol、0.8mol,同温同体积下,压强比等于气体物质的量之比,则体系的平衡压强与起始压强之比为1.8:1=9:5;(2) ①反应i为吸热反应,升高温度,平衡正向移动,CO的物质的量增大,反应ii为放热反应,升高温度,平衡逆向移动,CO的物质的量增大,CO2的物质的量减小,故温度升高,n(CO2)/n(CO)的值减小;②反应i为气体分子总数增大的反应,增大压强,CO的体积分数减小,反应ii为气体分子总数相等的反应,压强不影响平衡,增大压强,CO的体积分数不变,综上所述,增大压强,CO的体积分数减小,故P1>P2>P3;③设反应i中参加反应的CH3OH(g)的物质的量为x,则生成的CO的物质的量为x,应用差量法,反应i中气体总物质的量增大2x,反应ii中气体总物质的量不变,故平衡时容器内气体总物质的量为(2+2x)mol;体系中CO2的物质的量为0.2mol,则消耗CO的物质的量为,则平衡时CO的物质的量为(x-0.2)mol,结合图2得
CO(g)+2H2 △H =+90kJ·mol-1为吸热反应,升高温度,平衡正向移动,CHOH(g)的平衡转化率增大,B曲线正确;由图1可知,T1℃时,CH3OH(g)的平衡转化率为40%,则平衡体系中CH3OH(g)、CO(g)、H2的物质的量分别为0.6mol、0.4mol、0.8mol,同温同体积下,压强比等于气体物质的量之比,则体系的平衡压强与起始压强之比为1.8:1=9:5;(2) ①反应i为吸热反应,升高温度,平衡正向移动,CO的物质的量增大,反应ii为放热反应,升高温度,平衡逆向移动,CO的物质的量增大,CO2的物质的量减小,故温度升高,n(CO2)/n(CO)的值减小;②反应i为气体分子总数增大的反应,增大压强,CO的体积分数减小,反应ii为气体分子总数相等的反应,压强不影响平衡,增大压强,CO的体积分数不变,综上所述,增大压强,CO的体积分数减小,故P1>P2>P3;③设反应i中参加反应的CH3OH(g)的物质的量为x,则生成的CO的物质的量为x,应用差量法,反应i中气体总物质的量增大2x,反应ii中气体总物质的量不变,故平衡时容器内气体总物质的量为(2+2x)mol;体系中CO2的物质的量为0.2mol,则消耗CO的物质的量为,则平衡时CO的物质的量为(x-0.2)mol,结合图2得![]() ,解得,则反应ii的平衡常数
,解得,则反应ii的平衡常数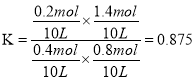 。
。


科目:高中化学 来源: 题型:
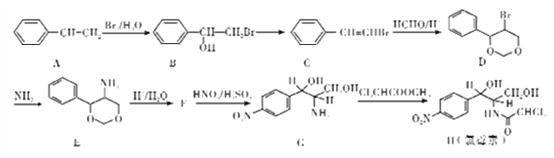
【题目】氯毒素是广谱抗菌素,主要用于治疗伤寒杆菌、痢疾杆菌、脑膜炎球菌、肺炎球菌的的感染。其中一种合成路线如下:
已知: 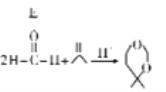
(1)A![]() B,G
B,G![]() H反应类型分别是:____、____。
H反应类型分别是:____、____。
(2)写出B![]() C的化学方程式(注明反应条件)________
C的化学方程式(注明反应条件)________
(3)写出F的结构简式_______
(4)写出H(氯霉素)分子中所们含氧官能团的名称____。1mol氯霉素最多消耗_____molNaOH。
(5)符合下列条件的E的同分异构体共有____________种。
①苯环上含有两个对位取代基,一个是氨基
②能水解
③能发生银镜反应
写出其中一种的结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类水解无关的是
A. 纯碱溶液可去除油污
B. 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂
C. TiCl4溶于大量水加热制备TiO2
D. 一定浓度NaHSO4溶液中加入甲基橙溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下,2H2O(g)![]() 2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
(2)乙醇水蒸气重整制氢
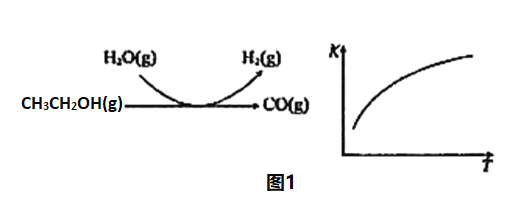
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1molH2(g),热量变化是62kJ,则该反应的热化学方程式为_____________。
(3)水煤气法制氢
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。
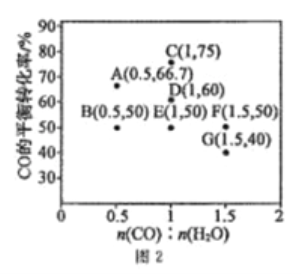
①向2L恒温恒容密闭容器中加入一定量的CO和0.1molH2O(g),在图中G点对应温度下,反应经5min达到平衡,则平均反应速率v(CO)=________。
②图中B、E两点对应的反应温度分别为TB和TE,则TB_____TE(填“>”“<”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G三点对应的_________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0molCO、1.0molH2O(g)、1.0molCO2和x molH2,为使上述反应开始时向正反应方向进行,则x应满足的条件是______。
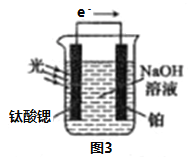
(4)光电化学分解制氢
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中反应物总能量小于生成物总能量的是( )
A.钠和水的反应
B.炭与水蒸气制水煤气的反应
C.盐酸与氢氧化钠溶液的反应
D.铝在氧气中燃烧的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
(1)氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”);理由是_____。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)
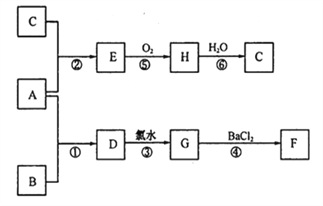
则:①A和B 分别为:A_________ B_________;
②A与B发生反应的条件是__________________;
③反应⑥的化学方程式为_____________________;
④上述反应中,不属于氧化还原反应的是_______________。(填数字序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
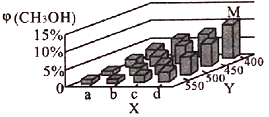
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
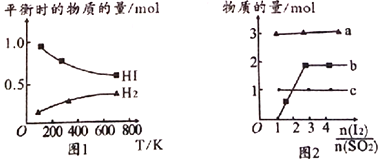
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. FeSO4酸性溶液中加H2O2溶液:Fe2++H2O2+2H+==Fe3++2H2O
B. 明矾溶液中加过量氢氧化钡溶液:Ba2++SO![]() == BaSO4↓
== BaSO4↓
C. 亚硫酸氢钠溶液中加氢氧化钠溶液:HSO![]() +OH-== SO
+OH-== SO![]() +H2O
+H2O
D. 稀硝酸加入碳酸银中有气泡产生:CO![]() +2H+==CO2↑+H2O
+2H+==CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com