
【题目】氯毒素是广谱抗菌素,主要用于治疗伤寒杆菌、痢疾杆菌、脑膜炎球菌、肺炎球菌的的感染。其中一种合成路线如下:
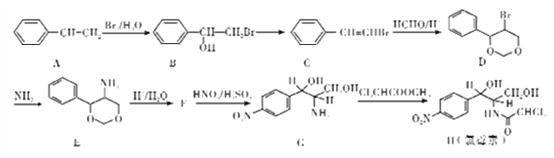
已知: 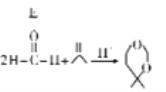
(1)A![]() B,G
B,G![]() H反应类型分别是:____、____。
H反应类型分别是:____、____。
(2)写出B![]() C的化学方程式(注明反应条件)________
C的化学方程式(注明反应条件)________
(3)写出F的结构简式_______
(4)写出H(氯霉素)分子中所们含氧官能团的名称____。1mol氯霉素最多消耗_____molNaOH。
(5)符合下列条件的E的同分异构体共有____________种。
①苯环上含有两个对位取代基,一个是氨基
②能水解
③能发生银镜反应
写出其中一种的结构简式___________
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是 ( )
A. 某无色溶液中可能大量存在H+、Cl-、MnO、K+
B. 使红色石蕊试纸变蓝的溶液中,H+、Al3+、Cl-、NO3-
C. Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+===2Fe3++2H2O
D. 稀硫酸与Ba(OH)2溶液的反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家冶炼出了纯度高达99、9999%的铁,你估计它不会具有的性质是
A. 硬度比生铁高 B. 在潮湿的空气中放置不易生锈
C. 与4mol/L盐酸的反应生成氢气 D. 在冷的浓H2SO4溶液中可钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________.
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。
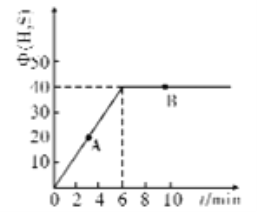
①A点COS的正反应速率_______(填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:

(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,其原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是___。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。该化合物溶液浓度为0.1 mol/L时, pH最接近_____。
A.5.6 B.7.0 C.8.4 D.13.0
(3)在一个装有可移动活塞的恒温容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g) ΔH<0,反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,此时总容积为1.0 L。
2CA3(g) ΔH<0,反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,此时总容积为1.0 L。
①达此平衡前各物质起始的量如下,其中不合理的是_______________;
A.C2 0.6mol, A2 0.5mol, CA3 0mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.55mol,A2 0.35mol,CA3 0.1mol
D.C2 0.8mol,A2 1.1mol,CA3 0mol
②此平衡体系的平衡常数K=____________________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将_________(填“正向”、“逆向”或“不”)移动。
(4)已知常温常压下,0.5mol B2A2与足量的D2反应,生成BD2和液态A2D,放出649.8 kJ 的热量。写出B2A2燃烧热的热化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是()
A.SO2能使品红溶液褪色,说明SO2具有漂白性
B.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
C.用HF来刻蚀玻璃,说明SiO2是碱性氧化物
D.雨水显酸性是因为吸收了空气中的CO2,pH小于1的雨水称为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com