
【题目】下列各组物质中,一定都属于纯净物的是( )
A.液氯和氯水
B.酒精溶液和乙醇
C.饱和食盐水和硫酸亚铁
D.干冰和混有冰的水
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏伽德罗常数用NA表示,则
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组合属于同素异形体的是
A. 3517Cl与3717Cl B. 金刚石与C60
C. CH3CH2CH2CH3和(CH3)2CHCH3 D. CH3CH3与CH3CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯毒素是广谱抗菌素,主要用于治疗伤寒杆菌、痢疾杆菌、脑膜炎球菌、肺炎球菌的的感染。其中一种合成路线如下:
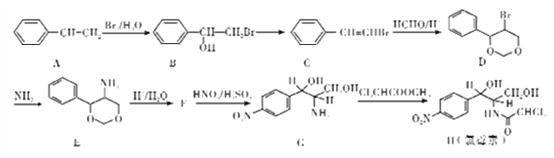
已知: 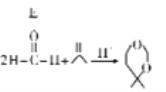
(1)A![]() B,G
B,G![]() H反应类型分别是:____、____。
H反应类型分别是:____、____。
(2)写出B![]() C的化学方程式(注明反应条件)________
C的化学方程式(注明反应条件)________
(3)写出F的结构简式_______
(4)写出H(氯霉素)分子中所们含氧官能团的名称____。1mol氯霉素最多消耗_____molNaOH。
(5)符合下列条件的E的同分异构体共有____________种。
①苯环上含有两个对位取代基,一个是氨基
②能水解
③能发生银镜反应
写出其中一种的结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
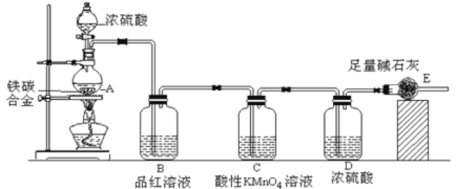
(1)仪器A的名称是___________。
(2)C装置的作用______________。
(3)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是___________。
A.A中反应不完全
B.反应生成的SO2部分被E中碱石灰吸收
C.E中碱石灰会吸收空气中的CO2和H2O
D.反应完全后,还有CO2气体滞留在装置体系中
(二)将19.20 g CuO和Fe2O3的混合物在高温下与足量的CO充分反应,反应后全部气体用200 mL 1.20 molL-1 Ba(OH)2溶液吸收,生成35.46 g白色沉淀(不考虑沉淀的溶解,忽略溶液体积的变化)。
(4)则吸收气体后溶液中溶质的化学式为________,其浓度为_________。
(5)混合物中CuO和Fe2O3的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备1,2一二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
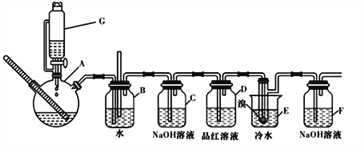
有关数据列表如下:

请按要求回答下列问题:
已知:CH3CH2OH![]() CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
(1)G中药品为1:3无水乙醇和浓硫酸混合液,用来制备乙烯,装置G的名称为_____
(2)装置B中长直导管的作用是_____________
(3)反应过程中应用冷水冷却装置E中大试管,但又不能过度冷却(如用冰水),其原因是_____
(4)某学生发现反应结束时,G中试剂消耗量大大超过理论值(装置不漏气),其原因是_____(任写出一种可能的原因)
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是______
(6)若消耗无水乙醇的体积为100 mL,制得1,2一二溴乙烷的体积为40 mL,则该反应的产率为___(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨厂和硝酸厂的烟气中含有大量的氮氧化物(NOx),脱硝通常是指将烟气中的氮氧化物转化为无毒无害的物质的化学过程。
(1)选择性催化还原技术(SCR)是目前最成熟的脱硝技术,即在金属催化剂的作用下,用还原剂(如NH3)选择性的与NOx反应生成N2和H2O。
已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)2NO(g) △H=+180kJmol-1
脱硝反应:4NH3(g)+6NO(g)5N2(g)+6H2O(g)的△H=_______kJmol-1
(2)将amolN2和3amolH2通入一密闭容器中在不同的温度和压强下发生反应:N2(g)+3H2(g)2NH3(g)。测得平衡体系中NH3的物质的量的分数如图所示。
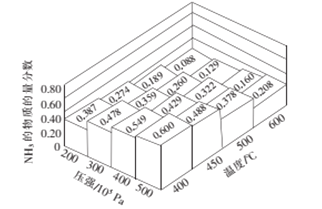
①下列可提高氨气产率的途径是__________。
A.尽量提高反应温度 B.对原料气适当加压
C.采用适当的催化剂 D.将氨气液化,不断移出液氨
②上图所示平衡体系中当NH3的物质的量分数分别为0.549和0.429时,该反应的平衡常数分别为K1和K2,则K1________K2(填写“>”,“<”或“=”)。当NH3的物质的量分数为0.600时,容器的体积为2L,此时该反应的化学平衡常数K=________。
(3)常温下,将NO和H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中其物质转化过程如图所示,
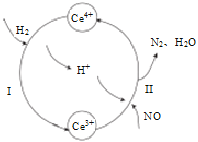
①反应I中氧化剂与还原剂的物质的量之比为_______。
②写出该过程的总化学反应方程式_____________________________________。
(4)直接电解吸收也是脱硝的一种方法,先用6%的稀硝酸吸收NOx,会生成HNO2(一种一元弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,其电解装置如图所示。
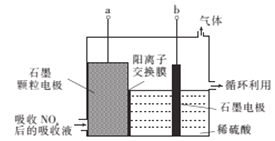
①图中b应连接电源的_______(“正极”或“负极”)。
②阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类水解无关的是
A. 纯碱溶液可去除油污
B. 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂
C. TiCl4溶于大量水加热制备TiO2
D. 一定浓度NaHSO4溶液中加入甲基橙溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
(1)氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”);理由是_____。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)
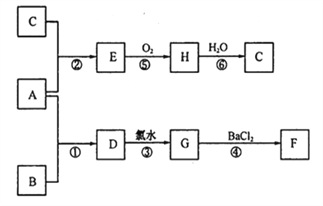
则:①A和B 分别为:A_________ B_________;
②A与B发生反应的条件是__________________;
③反应⑥的化学方程式为_____________________;
④上述反应中,不属于氧化还原反应的是_______________。(填数字序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com