
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
科目:高中化学 来源: 题型:
【题目】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________.
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。
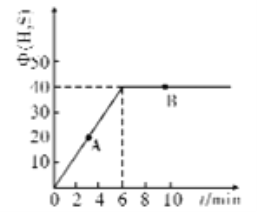
①A点COS的正反应速率_______(填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是()
A.SO2能使品红溶液褪色,说明SO2具有漂白性
B.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
C.用HF来刻蚀玻璃,说明SiO2是碱性氧化物
D.雨水显酸性是因为吸收了空气中的CO2,pH小于1的雨水称为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)![]() LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
A. 重新达到新平衡时H2的压强仍然为2Mpa
B. 当LaNi5的浓度不再变化时,表明达到平衡状态
C. 扩大容器体积,重新达到平衡时n(H2)增多
D. 增大压强。降低温度,有利于储氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 自发反应在任何条件下都能实现
B. 化学反应不一定都有能量变化
C. 升高温度,活化分子百分数增大,化学反应速率一定增大
D. 一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图.下列分析正确的是
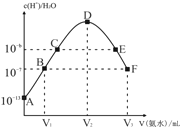
A. 稀硫酸的浓度为0.1mol/L
B. C点和E点溶液:pH=14-a
C. c(NH4+)/c(NH3·H2O);B点>F点
D. E溶液中存在c(NH4+)>c(SO42-)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si+4HCl。
Si+4HCl。
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ②为化合反应
C. ①②③均为氧化还原反应
D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com