
【题目】在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)![]() LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
A. 重新达到新平衡时H2的压强仍然为2Mpa
B. 当LaNi5的浓度不再变化时,表明达到平衡状态
C. 扩大容器体积,重新达到平衡时n(H2)增多
D. 增大压强。降低温度,有利于储氢
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)不溶于乙醇,20℃、80℃时溶解度依次为70.1、231g/100gH2O。可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4、Na2CO3等)及纯碱等为原料制备Na2S2O3·5H2O的实验流程如下:

(1)用Na2S2O3脱除纸浆中多余Cl2的离子反应方程式为__________。
(2)“净化”时加入的试剂X可能是__________ (填化学式)。
(3)“趁热过滤”时,用双层滤纸过滤的原因是__________。
(4)制备Na2S2O3的实验装置如下图所示:

①装置连接好并装入药品后,检验装置是否漏气的方法是__________。
②实验过程中打开螺旋夹并调节螺旋夹至适当的位置,一方面使反应产生的SO2气体较均匀地通入Na2S-Na2CO3溶液中,另一方面的作用是__________。
③请设计由三口烧瓶中的反应液制备Na2S2O3·5H2O的实验方案:拆解装置,__________,将固体放在40℃烘箱中干燥40min,制得Na2S2O3·5H2O(实验中须使用的试剂有:2mol·L-1NaOH溶液、95%乙醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备1,2一二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
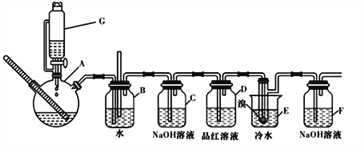
有关数据列表如下:

请按要求回答下列问题:
已知:CH3CH2OH![]() CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
(1)G中药品为1:3无水乙醇和浓硫酸混合液,用来制备乙烯,装置G的名称为_____
(2)装置B中长直导管的作用是_____________
(3)反应过程中应用冷水冷却装置E中大试管,但又不能过度冷却(如用冰水),其原因是_____
(4)某学生发现反应结束时,G中试剂消耗量大大超过理论值(装置不漏气),其原因是_____(任写出一种可能的原因)
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是______
(6)若消耗无水乙醇的体积为100 mL,制得1,2一二溴乙烷的体积为40 mL,则该反应的产率为___(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类水解无关的是
A. 纯碱溶液可去除油污
B. 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂
C. TiCl4溶于大量水加热制备TiO2
D. 一定浓度NaHSO4溶液中加入甲基橙溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
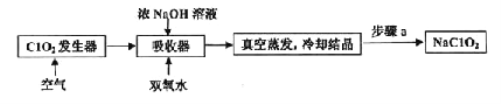
A. 通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B. 吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C. 步骤a的操作包括过滤、洗涤和干燥
D. 工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中反应物总能量小于生成物总能量的是( )
A.钠和水的反应
B.炭与水蒸气制水煤气的反应
C.盐酸与氢氧化钠溶液的反应
D.铝在氧气中燃烧的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
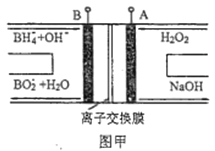
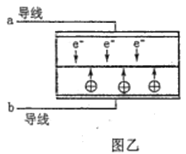
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com