
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
【答案】B
【解析】A.醋酸为弱酸,醋酸钠为强酸弱碱盐,水解呈碱性,溶液中存在醋酸分子,故A错误;B.常温下,pH=13的NaOH溶液中c(OH-)=0.1mol/L,pH=2的H2SO4溶液中c(H+)=0.01mol/L,酸碱混合后溶液呈碱性,说明NaOH过量,且pH=11,说明反应后c(OH-)=0.001mol/L,则:c(OH-)=![]() =0.001mol/L,解之得:V(H2SO4):V(NaOH)=9:1,故B正确;C.硫化钠溶液中存在物料守恒,为c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)=0.2mol/L,则c(S2-)+c(HS-)+c(H2S)=0.1mol/L,故C错误;D.溶液存在Cl-、NH4+、H+、OH-,当溶液pH=7时,c(H+)=c(OH-),c(NH4+)=c(Cl-),故D错误;故选B。
=0.001mol/L,解之得:V(H2SO4):V(NaOH)=9:1,故B正确;C.硫化钠溶液中存在物料守恒,为c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)=0.2mol/L,则c(S2-)+c(HS-)+c(H2S)=0.1mol/L,故C错误;D.溶液存在Cl-、NH4+、H+、OH-,当溶液pH=7时,c(H+)=c(OH-),c(NH4+)=c(Cl-),故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列叙述中正确的是( )
A. 标准状况下,22.4 L SO3中含SO3分子数为NA
B. 46 g NO2中含有分子数为NA
C. 标况下22.4L Cl2与足量的NaOH溶液反应,转移的电子数为2NA
D. 标况下,足量的Fe与22.4L Cl2发生燃烧反应(Cl2完全反应),转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.9 g镁铝合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的体积是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丙醇异丁酸酯(![]() )是一种合成香料,其中一种合成路线如图:
)是一种合成香料,其中一种合成路线如图:

已知:R-CH=CH2![]() R-CH2CH2OH。请回答下列问题:
R-CH2CH2OH。请回答下列问题:
(1)A的化学名称是______________,B中含有的官能团名称是________________。
(2)在一定条件下,A与水反应也可以生成B或另外一种生成物,该反应的反应类型为___________,“另外一种生成物”的结构简式为_____________________________。
(3)C可被新制的Cu(OH)2悬浊液氧化,也可以被其他氧化剂所氧化。写出C与银氨溶液反应的化学方程式:_____________________________。
(4)D的核磁共振氢谱显示为6组峰,且峰面积之比为1∶1∶1∶1∶2∶2,则D的结构简式为_______________;D的同分异构体有多种,其中苯环上有两个不含环状的取代基,并能与Na反应的同分异构体有_______种(不含立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,分子数为NA的CO2、N2O混合气体体积约为22.4L,质量为44克
B. 常温常压下,16gO2所含的原子数为NA
C. 由O2和NO2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D. 标准状况下,22.4LH2O所合的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3 ![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物分离和提纯常用下图装置进行,按要求回答下列问题:
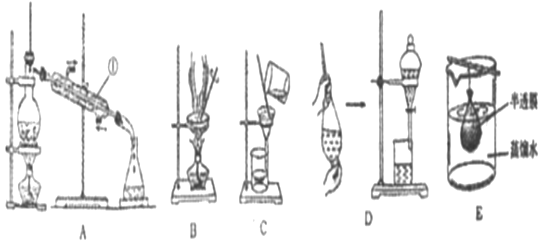
(1)仪器①的名称________________________。
(2)明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2CO3、Na2SO4的混合溶液应选用装置的为(用上图字母填写)____________________。如何证明SO42-已分离出来______________________。
(3)在装置D中加入10 mL碘水,然后再注入4 mL苯,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:________________________。操作完毕后,为得到碘并回收苯可用______________法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com