
【题目】(1)将30mL0.5mol/L的H2SO4溶液加水稀释到500mL后,从中取出50mL溶液的物质的量浓度为___。
(2)常温下,将20.0g14%的NaOH溶液跟30.0g24%的NaOH溶液混合,混合后得到1.2g/mL的混合液,试计算:
①混合后的溶液中NaOH的质量分数为___。
②混合后的溶液中NaOH的物质的量浓度为___mol/L。
③配制100mL同浓度溶液需要溶解___g的NaOH才能使其浓度与上述混合液浓度相等。
(3)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2的物质的量之比为___。
【答案】0.03 mol/L 20% 6 24 2:1
【解析】
(1)根据溶液稀释过程中溶质不变计算;
(2)①计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氢氧化钠的质量之和计算混合后溶质氢氧化质量分数;
②根据c=![]() 计算混合后氢氧化钠的物质的量浓度;
计算混合后氢氧化钠的物质的量浓度;
③根据n=cV计算需要氢氧化钠的物质的量,再根据m=nM计算氢氧化钠的质量.
(3)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程计算x、y的值,据此解答。
(1)设溶液稀释后浓度为cmol/L,则将30mL0.5mol/L的H2SO4溶液加水稀释到500mL后,可得:cmol/L×0.5L=0.5mol/L×0.03L,解得c=0.03;溶液是均一稳定的混合物,则稀释后取出50mL溶液的物质的量浓度为0.03 mol/L;
(2)①将20.0g14%的NaOH溶液跟30.0g24%的NaOH溶液混合,混合后溶液的质量为20g+30g=50g,令混合后氢氧化钠的质量分数为ω,则:50g×ω=20g×14%+30g×24%,解得ω=20%;
②混合后溶液的密度为1.2g/mL,氢氧化钠的质量分数为20%,则c(NaOH)=![]() mol/L=6mol/L;
mol/L=6mol/L;
③配制100mL 6mol/L的氢氧化钠溶液,需要氢氧化钠的物质的量为:0.1L×6mol/L=0.6mol,故需要氢氧化钠的质量为:0.6mol×40g/mol=24g;
(3)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程,则:28x+44y=20、x+y=![]() ,解得x=0.04,y=0.02,故CO和CO2的物质的量之比为0.04mol:0.02mol=2:1。
,解得x=0.04,y=0.02,故CO和CO2的物质的量之比为0.04mol:0.02mol=2:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】同分异构现象在有机化学中是非常普遍的,下列有机化合物不是同分异构体的一组是( )
①CH2=CHCH3②![]() ③CH3CH2CH3④CH3CH2CH=CH2⑤
③CH3CH2CH3④CH3CH2CH=CH2⑤![]() ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3
A. ①和②
B. ①和③
C. ④和⑥
D. ⑤和⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某溶液中滴加氢氧化钠溶液产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示。该溶液中可能含有的离子组是( )
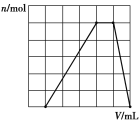
A.Na+、Mg2+、Al3+、NO3-、Cl-
B.Cu2+、H+、Fe3+、Mg2+、SO42-
C.NH4+、H+、Al3+、HCO3-、NO3-
D.NH4+、H+、Al3+、SO42-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学常见的几种物质①NaOH溶液②铜丝③液氯④盐酸⑤稀硫酸⑥氨水⑦CO2⑧熔融NaCl⑨蔗糖晶体⑩酒精。属于非电解质的是________,属于电解质的是________。
(2)工业上可用浓氨水检查氯气管道是否漏气。若有Cl2漏出,与浓氨水接触会有白烟生成,同时产生一种无毒、无可燃性、不污染大气的气体。有关的化学方程式是________:。该反应中氧化剂和还原剂的物质的量之比为________。
(3)铁酸钠(Na2FeO4)是水处理过程中一种新型的净水型,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
①配平制取铁酸钠的化学方程式:____Fe(NO3)3+____NaOH+ ____Cl2——____Na2FeO4 +____NaNO3+____NaCl+____H2O
②用单线桥法标出反应中电子转移的方向和数目____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组学习电化学后,设计了下面的实验装置图,则下列有关该装置图的说法中正确的是 ( )
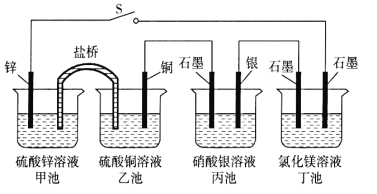
A. 合上电键后,盐桥中的阳离子向甲池移动
B. 合上电键后,丙池为电镀银的电镀池
C. 合上电键后一段时间,丙池中溶液的pH增大
D. 当丁池中生成标准状况下1120 mL Cl2气体时,丁池中理论上最多产生2.9 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:

相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。

(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应又属于氧化还原反应的是 ( )
A.C+O2 ![]() CO2
CO2
B.2 KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
C.HCl+NaOH = NaCl+H2O
D.Fe+CuSO4=Cu+FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成Li2O外,也生成微量的_________(填化学式)。
(2)铍的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________________________________________。
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),a属于________(填“离子”或“共价”)化合物,写出它的一个等电子体_________。
(4)二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________(标出配位键)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com