
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30 mL 0.1 mol·L1 H2A溶液中逐滴加入等浓度NaOH溶液时pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是
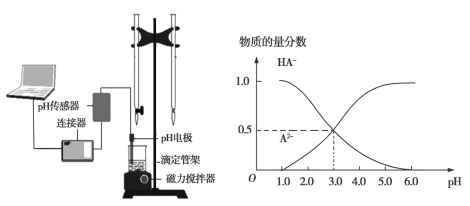
A. pH=4.0时,溶液中n(HA)约为2.73×104 mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1 mol·L1NaHA溶液中存在c(A2)+c(HA)+c(H2A)=0.1 mol·L1
【答案】D
【解析】
由图可知pH=3时,溶液中不存在H2A,说明H2A第一步完全电离,第二步部分电离。pH=3时A2-、HA-的物质的量分数相等,所以二者的浓度相等,则Ka2=![]() =c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,据此计算n(HA-);本实验是碱滴定酸,酸式滴定管用来盛放酸,碱式滴定管用来盛放碱;由图可知,pH=3时,溶液中c(A2-)=c(HA-);该二元酸第一步完全电离,第二步部分电离,所以NaHA溶液中不存在H2A。
=c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,据此计算n(HA-);本实验是碱滴定酸,酸式滴定管用来盛放酸,碱式滴定管用来盛放碱;由图可知,pH=3时,溶液中c(A2-)=c(HA-);该二元酸第一步完全电离,第二步部分电离,所以NaHA溶液中不存在H2A。
由图可知H2A第一步完全电离,第二步部分电离。pH=3时A2-、HA-的物质的量分数相等,所以二者的浓度相等,则Ka2=![]() =c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,解得溶液中n(HA)约为2.73×104 mol,A正确;碱滴定酸,碱不能盛放在左边的酸式滴定管中,应该使用右边的碱式滴定管,B正确;由图可知,pH=3时,溶液中c(A2-)=c(HA-),则等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0,C正确;该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2-)+c(HA-)=0.1mol/L,D错误。
=c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,解得溶液中n(HA)约为2.73×104 mol,A正确;碱滴定酸,碱不能盛放在左边的酸式滴定管中,应该使用右边的碱式滴定管,B正确;由图可知,pH=3时,溶液中c(A2-)=c(HA-),则等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0,C正确;该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2-)+c(HA-)=0.1mol/L,D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A.M点对应的溶液中:K+、Fe2+、SO![]() 、NO
、NO![]()
B.N点对应的溶液中:K+、NH![]() 、Cl、CO
、Cl、CO![]()
C.S点对应的溶液中:Na+、SO![]() 、HCO
、HCO![]() 、NO
、NO![]()
D.R点对应的溶液中:Na+、SO![]() 、Cl、NO
、Cl、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子结构如图所示。现有试剂:①Na ②H2/Ni ③Ag(NH3)2OH ④新制Cu(OH)2 ⑤NaOH ⑥酸性KMnO4溶液。能与该化合物中两个或两个以上官能团都发生反应的试剂有( )

A.①②⑤⑥ B.①②④⑥ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol/L氨水分别滴定20.0mL 0.1mol/L的盐酸和醋酸,曲线如图所示,下列叙述中不正确的是
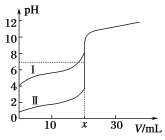
A. x=20
B. Ⅰ曲线表示的是滴定醋酸的曲线
C. 滴定过程中![]() 的值逐渐减小
的值逐渐减小
D. 当Ⅰ曲线和Ⅱ曲线pH均为7时,某一溶液中的c(Cl-)大于另一溶液中的c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18.7kJ·mol-1
则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=_______。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2O![]() HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>0
HCN(g)+3H2 (g) △H>0
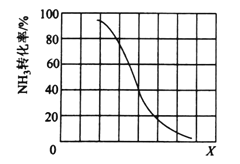
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如下图所示。X代表的是______(填“温度”或“压强”)。
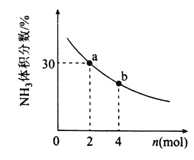
②其他条件一定,向2L密闭容器中加入nmolCH4和2molNH3,平衡时NH3体积分数随n变化的关系如下图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为______;该温度下,b点的平衡常数为________
(4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作______极,阴极生成Cu2O的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家倡导推进传统产业改造升级,引导企业创新优化产业结构。其根本目的是节能减排,“减排”的关键是减少CO2排放,而“减排”的重要手段是合理利用CO2。回答下列问题:
(1)CO2的电子式是___。
(2)利用CO2可合成尿素[CO(NH2)2],合成原料除CO2外,还有NH3。该方法制备尿素的化学方程式是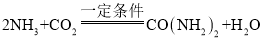 ,该方法制备尿素一般需
,该方法制备尿素一般需![]() >2,即NH3过量,原因是____。
>2,即NH3过量,原因是____。
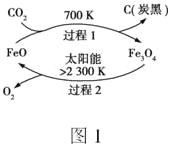
(3)利用太阳能,以CO2为原料制取炭黑的流程如图1所示:一定条件“过程1”生成1mol炭黑的反应热为ΔH1;“过程2”的热化学方程式为:2Fe3O4(s)![]() 6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___。
6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___。
(4)将1mol CO2和3mol H2充入容积为1L的恒容密闭容器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
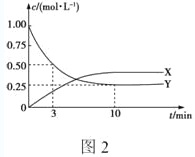
①图2是测得的该反应中X、Y的浓度随时间变化的曲线,其中X为___(写化学式),反应达到平衡时的平均反应速率v(H2)=____mol·L-1·min-1。
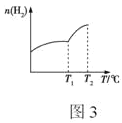
②不同温度下平衡时,混合气体中H2的物质的量随温度的变化曲线如图3所示,则该反应的ΔH____0(填“>”“<”或“不能确定”);测定温度小于T2时,反应体系中无O2存在,则T1~T2的温度范围内,H2的物质的量急剧增大的原因可能是____。
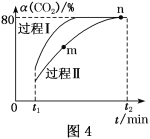
(5)CO2还可以合成甲醇:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___。
H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg和SiO2在高温下反应生成MgO和Mg2Si。下列说法正确的是
A. 物质的熔点:Mg>MgOB. 氧元素不存在同素异形体
C. Mg的还原性强于SiD. 该反应是置换反应,镁元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量为______、______、________
(2)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为_________。
(3)一种不纯的铁,已知它含有铜、铝、镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若电子转移的数目为5NA,则有212克氯气生成
B. 常温常压下,40g氖气所含的分子数目为2NA
C. 含2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com