
【题目】请按要求作答:
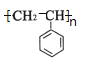
(1)分子式为C4H8且属于烯烃的有机物的同分异构体(考虑顺反异构)有 _________种;![]() 高聚物的单体的结构简式是_____________ 和______________。
高聚物的单体的结构简式是_____________ 和______________。
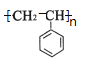
(2) ![]() 的名称为:_______________;写出
的名称为:_______________;写出![]() 聚合生成高分子化合物的化学方程式________;
聚合生成高分子化合物的化学方程式________;
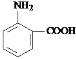
(3)已知-NH2表现碱性,-NO2表现中性,-COOH表现酸性。化学式为C7H7NO2的有机物,其分子结构中有1个苯环、2个取代基,试按照下列写出2种同分异构体(只写邻位即可)。
①该有机物既有酸性又有碱性______________。
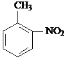
②该有机物既无酸性又无碱性______________。
【答案】4 ![]() CH2=CH-CH=CH2 苯乙烯 n
CH2=CH-CH=CH2 苯乙烯 n![]()

【解析】
(1)C4H8属于烯烃的同分异构体有:CH2═CHCH2CH3、CH3CH═CHCH3,CH2═C(CH3)2,其中CH2═CHCH2CH3含有顺式和反式两种异构体,所以C4H8属于烯烃的同分异构体有4种;![]() 是由苯乙烯和1,3—丁二烯发生加聚反应制得;
是由苯乙烯和1,3—丁二烯发生加聚反应制得;
故答案为:4,![]() ,CH2=CH-CH=CH2;
,CH2=CH-CH=CH2;
(2) ![]() 可命名为苯乙烯,苯乙烯发生加聚反应生成聚苯乙烯,方程式为:n
可命名为苯乙烯,苯乙烯发生加聚反应生成聚苯乙烯,方程式为:n![]()

 ;
;
故答案为:苯乙烯,n![]()

![]() ;
;
(3)根据信息可知,该有机物既有酸性又有碱性,说明该有机物既含有氨基又含有羧基,且必须含有苯环和2个取代基,即该物质为: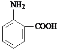 ;若该有机物既不显酸性也不显碱性,即一定不含有氨基和羧基,又需要含有N元素和C元素,所以该化合物可能含有硝基和甲基,故该化合物可能为:邻硝基甲苯,结构简式为:
;若该有机物既不显酸性也不显碱性,即一定不含有氨基和羧基,又需要含有N元素和C元素,所以该化合物可能含有硝基和甲基,故该化合物可能为:邻硝基甲苯,结构简式为:![]() ,
,
故答案为: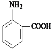 ,
,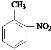 。
。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】2018年12月8日,凌晨2时23分,我国在西昌卫星发射中心,嫦娥四号探测器搭载长征三号乙运载火箭成功发射,实现了世界首次月球背面软着陆和巡视探测,被认为是中国在工程技术和空间科学方面的双重跨越和创新。
I.肼(N2H4)又称联氨,常温时是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是___________________________________________________。
II.如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
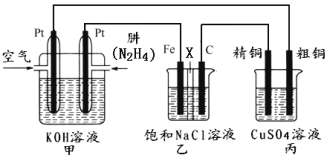
根据要求回答相关问题:
(2)甲装置中正极的电极反应式为:______________________________________。
(3)检验乙装置中石墨电极反应产物的方法是:___________________________。
(4)如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________g。
III.对金属制品进行抗腐蚀处理,可延长其使用寿命。该研究性学习小组又以肼(N2H4)─空气燃料电池为电源对铝材表面进行如下处理:
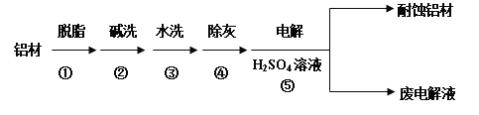
(5)流程⑤中以铝材为阳极,在H2SO4 溶液中电解,最终可在铝材表面形成氧化膜,该电解的阳极电极反应式为__________________________________。
(6)取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,其反应的离子方程式是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18.7kJ·mol-1
则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=_______。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2O![]() HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>0
HCN(g)+3H2 (g) △H>0
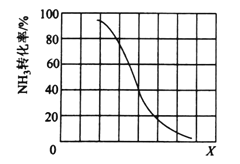
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如下图所示。X代表的是______(填“温度”或“压强”)。
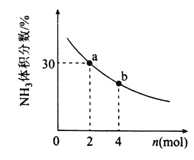
②其他条件一定,向2L密闭容器中加入nmolCH4和2molNH3,平衡时NH3体积分数随n变化的关系如下图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为______;该温度下,b点的平衡常数为________
(4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作______极,阴极生成Cu2O的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg和SiO2在高温下反应生成MgO和Mg2Si。下列说法正确的是
A. 物质的熔点:Mg>MgOB. 氧元素不存在同素异形体
C. Mg的还原性强于SiD. 该反应是置换反应,镁元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,48gO2与O3的混合物中含有的氧原子数为3NA
B.0.1 mol·L-1 NaCl溶液中Na+子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量为______、______、________
(2)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为_________。
(3)一种不纯的铁,已知它含有铜、铝、镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.35g二氧化锰与浓盐酸(密度为1.19gcm﹣3、质量分数为36.5%)完全反应.求:
(1)浓盐酸的物质的量浓度为多少?_______
(2)将所得气体全部用石灰乳吸收,可得到漂白粉的质量.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
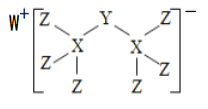
A. Y元素对应的最高价氧化物的水化物是强酸
B. 原子半径:X>Y>Z
C. 该新化合物中的Y元素不满足8电子稳定结构
D. Y、Z两元素可形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com