
ЁОЬтФПЁПгаЙиЮяжЪЕФСПЕФМЦЫуЬюПеЃК
ЃЈ1ЃЉ2 molФђЫи[CO(NH2)2]КЌ_____________ИіHдзгЃЌЫљКЌбѕдзгИњ__________g H2OЫљКЌбѕдзгИіЪ§ЯрЕШЁЃ
ЃЈ2ЃЉЂйБъзМзДПіЯТЃЌ22.4 L CH4ЃЛЂк1.5 mol NH3ЃЛЂл1.806ЁС1024ИіH2OЃЛЂмБъзМзДПіЯТЃЌ73 g HClЁЃЫљКЌHдзгИіЪ§гЩЖрЕНЩйЕФЫГађЪЧ____________________ЁЃ
ЃЈ3ЃЉ30.9 g NaRКЌгаNaЃЋ0.3 molЃЌдђNaRЕФФІЖћжЪСПЮЊ_________________ЁЃ
ЃЈ4ЃЉ100mLФГAl2(SO4)3ШмвКжаЃЌc(Al3ЃЋ)ЃН2.0 molЁЄLЃ1ЃЌдђЦфжаc(SO42Ѓ)ЃН_________molЁЄLЃ1ЁЃ
ЁОД№АИЁП8ЁС6.02ЁС1023 36 Ђл>Ђк>Ђй>Ђм 103g/mol 3.0
ЁОНтЮіЁП
ЃЈ1ЃЉДгЛЏбЇЪНПДЃЌ2 molФђЫи[CO(NH2)2]КЌ8molHдзгЃЌКЌ2molбѕдзгЃЌдђКЌбѕдзгИіЪ§ЯрЕШЕФH2OвВгІЮЊ2molЃЌгЩДЫПЩЧѓГіЦфжЪСПЁЃ
ЃЈ2ЃЉЂйБъзМзДПіЯТЃЌ22.4 L CH4ЮЊ1molЃЌКЌ4molHдзгЃЛЂк1.5 mol NH3КЌ4.5molHдзгЃЛЂл1.806ЁС1024ИіH2OКЌ6molHдзгЃЛЂмБъзМзДПіЯТЃЌ73 g HClЮЊ2molЃЌКЌ2molHдзгЁЃБШНЯПЩЕУГіЫљКЌHдзгИіЪ§гЩЖрЕНЩйЕФЫГађЁЃ
ЃЈ3ЃЉ30.9 g NaRКЌгаNaЃЋ0.3 molЃЌдђNaRЮЊ0.3molЃЌФІЖћжЪСПЮЊ![]() ЁЃ
ЁЃ
ЃЈ4ЃЉ100mLФГAl2(SO4)3ШмвКжаЃЌc(Al3ЃЋ)ЃН2.0 molЁЄLЃ1ЃЌдђЦфжаc(SO42Ѓ)ЃН![]() molЁЄLЃ1ЁЃ
molЁЄLЃ1ЁЃ
ЃЈ1ЃЉДгЛЏбЇЪНПДЃЌ2 molФђЫи[CO(NH2)2]КЌ8molHдзгЃЌЦфИіЪ§ЮЊ8ЁС6.02ЁС1023ЃЛКЌ2molбѕдзгЃЌдђКЌбѕдзгИіЪ§ЯрЕШЕФH2OвВгІЮЊ2molЃЌЦфжЪСПЮЊ2molЁС18g/mol=36gЁЃД№АИЮЊЃК8ЁС6.02ЁС1023ЃЛ36ЃЛ
ЃЈ2ЃЉЂйБъзМзДПіЯТЃЌ22.4 L CH4ЮЊ1molЃЌКЌ4molHдзгЃЛЂк1.5 mol NH3КЌ4.5molHдзгЃЛЂл1.806ЁС1024ИіH2OКЌ6molHдзгЃЛЂмБъзМзДПіЯТЃЌ73 g HClЮЊ2molЃЌКЌ2molHдзгЁЃБШНЯПЩЕУГіЫљКЌHдзгИіЪ§гЩЖрЕНЩйЕФЫГађЂл>Ђк>Ђй>ЂмЁЃД№АИЮЊЃКЂл>Ђк>Ђй>ЂмЃЛ
ЃЈ3ЃЉ30.9 g NaRКЌгаNaЃЋ0.3 molЃЌдђNaRЮЊ0.3molЃЌФІЖћжЪСПЮЊ![]() ЁЃД№АИЮЊЃК103g/molЃЛ
ЁЃД№АИЮЊЃК103g/molЃЛ
ЃЈ4ЃЉ100mLФГAl2(SO4)3ШмвКжаЃЌc(Al3ЃЋ)ЃН2.0 molЁЄLЃ1ЃЌдђЦфжаc(SO42Ѓ)ЃН![]() molЁЄLЃ1=3.0 molЁЄLЃ1ЁЃД№АИЮЊЃК3.0ЁЃ
molЁЄLЃ1=3.0 molЁЄLЃ1ЁЃД№АИЮЊЃК3.0ЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇЗДгІЙ§ГЬЗЂЩњЮяжЪБфЛЏЭЌЪБГЃГЃАщФмСПБфЛЏЃЌЫќвдШШФмаЮЪНБэЯжГіРДЃЌНаЗДгІШШЃЌЫќгаКмЖржжЃЌШМЩеШШЃЌжаКЭШШЕШЁЃ
(1)ЯТСаІЄHБэЪОЮяжЪШМЩеШШЕФЪЧ_____(ЬюІЄH1ЁЂІЄH2ЛђІЄH3ЃЌЯТЭЌ)ЃЛБэЪОжаКЭШШЕФЪЧ____ЁЃ
A. 2H2(g)+O2(g)=2H2O(l) ІЄH1
B. C(s)+ O2(g)=CO(g) ІЄH2
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ІЄH3
D. C(s)+ O2(g)=CO2(g) ІЄH4
E. C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) ІЄH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ІЄH6
G.2NaOH(aq)+H2SO4(aq)=NaSO4(aq)+2H2O(l) ІЄH7
(2)вбжЊ15gввЭщЭъШЋШМЩеЩњГЩCO2КЭвКЬЌЫЎЃЌЗХШШakJЃЌЯТСаШШЛЏбЇЗНГЬЪНе§ШЗЪЧЃЈ________ЃЉЁЃ
A. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ІЄH1=+2a kJЁЄmol-1
B. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ІЄH1=-2a kJЁЄmol-1
C. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ІЄH1=-4a kJЁЄmol-1
D. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ІЄH1=+4a kJЁЄmol-1
(3)ГфЗжШМЩевЛЖЈСПЖЁЭщ(C4H10)ЗХГіШШСП161.9kJЃЌЧвЩњГЩЕФCO2ЧЁКУФмгы2.5mol/L 100mLЕФЧтбѕЛЏБЕШмвКЭъШЋЗДгІЩњГЩГСЕэЃЌдђШМЩе1molЖЁЭщЗХГіФмСПЮЊ__________ЁЃ
(4)НјвЛВНбаОПБэУїЃЌЛЏбЇЗДгІФмСПБфЛЏгыМќФмгаЙиЃЌМќФмМђЕЅРэНтЖЯПЊ1molЛЏбЇМќЮќЪеФмСПЁЃЯТБэЪЧМќФмЪ§ОнЃК
ЛЏбЇМќ | PЁЊP | PЁЊO | O=O | P=O |
МќФм(kJЁЄmol-1) | 197 | 360 | 499 | X |
вбжЊАзСзШМЩеШШЮЊ2378.0kJЁЄmol-1ЃЌдђX=__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌдквЛЙЬЖЈШнЛ§ЕФУмБеШнЦїжаЗЂЩњЗДгІH2(g)ЃЋI2(g)![]() 2HI(g)ЃЌХаЖЯИУЗДгІДяЕНЦНКтЕФБъжОЪЧ ( )
2HI(g)ЃЌХаЖЯИУЗДгІДяЕНЦНКтЕФБъжОЪЧ ( )
A. ЛьКЯЦјЬхЕФбеЩЋВЛдйИФБфB. H2ЁЂI2ЁЂHIЕФХЈЖШЯрЕШ
C. ЛьКЯЦјЬхЕФУмЖШБЃГжВЛБфD. H2ЁЂI2ЁЂHIЗжзгИіЪ§БШЮЊ1ЁУ1ЁУ2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЯрЙижЊЪЖЬюПеЃЈNAДњБэАЂЗќйЄЕТТоГЃЪ§ЕФЪ§жЕЃЉЁЃ
ЃЈ1ЃЉБъзМзДПіЯТ 11.2L NH3 жаКЌ_______ИіАБЗжзгЁЃ
ЃЈ2ЃЉЮяжЪЕФСПЯрЕШЕФSO2 КЭ SO3 ЫљКЌЕФбѕдзгЪ§ФПжЎБШЮЊ__________ЁЃ
ЃЈ3ЃЉ4.8g CH4 жаЫљКЌЧтдзгЕФЮяжЪЕФСПЮЊ______________ЁЃ
ЃЈ4ЃЉ12.4 g Na2R КЌ Na+0.4 molЃЌдђ Na2R ЕФФІЖћжЪСПЮЊЮЊ_________________ЁЃ
ЃЈ5ЃЉБъПіЯТЃЌвЛЖЈСПЕФ N2 гы 22.4L CO ЫљКЌЕФЗжзгЪ§ЯрЕШЃЌдђ N2 ЕФжЪСПЮЊ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБъзМзДПіЯТЃЌЕШЬхЛ§ЕФNH3КЭCH4СНжжЦјЬхЃЌЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧ
A.ЫљКЌЗжзгЪ§ФПЯрЭЌB.ЫљКЌЧтдзгЮяжЪЕФСПжЎБШЮЊ3ЁУ4
C.жЪСПжЎБШЮЊ16ЁУ17D.УмЖШжЎБШЮЊ17ЁУ16
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯГЃЛиЪевБСЖаПЗЯдќжаЕФаПЃЈКЌгаZnOЁЂFeOЁЂFe2O3ЁЂCuOЁЂAl2O3ЕШдгжЪЃЉЃЌВЂгУРДЩњВњZn(NO3)2ЁЄ6H2OОЇЬхЃЌЦфЙЄвеСїГЬЮЊЃК
гаЙиЧтбѕЛЏЮяПЊЪМГСЕэКЭГСЕэЭъШЋЕФpHШчЯТБэЃК
ЧтбѕЛЏЮя | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
ПЊЪМГСЕэЕФpH | 3ЃЎ3 | 1ЃЎ5 | 6ЃЎ5 | 4ЃЎ2 | 5ЃЎ4 |
ГСЕэЭъШЋЕФpH | 5ЃЎ2 | 3ЃЎ7 | 9ЃЎ7 | 6ЃЎ7 | 8ЃЎ0 |
ЂХдкЁАЫсНўЁБВНжшжаЃЌЮЊЬсИпаПЕФНўГіЫйТЪЃЌГ§ЭЈШыПеЦјЁАНСАшЁБЭтЃЌЛЙПЩВЩШЁЕФДыЪЉЪЧ_____________________ЁЃ
ЂЦЩЯЪіЙЄвеСїГЬжаЖрДІЩцМАЁАЙ§ТЫЁБЃЌЪЕбщЪвжаЙ§ТЫВйзїашвЊЪЙгУЕФВЃСЇвЧЦїга_____ЁЃ
ЂЧдкЁАГ§дгIЁБВНжшжаЃЌашдйМгШыЪЪСПH2O2ШмвКЃЌH2O2гыFe2+ЗДгІЕФРызгЗНГЬЪНЮЊ_____ЁЃЮЊЪЙFe(OH)3ЁЂAl(OH)3ГСЕэЭъШЋЃЌЖјZn(OH)2ВЛГСЕэЃЌгІПижЦШмвКЕФpHЗЖЮЇЮЊ_____ЁЃМьбщFe3+ЪЧЗёГСЕэЭъШЋЕФЪЕбщВйзїЪЧ_____ЁЃ
ЂШМгШыZnЗлЕФзїгУЪЧ_____ЁЃЁАВйзїAЁБЕФУћГЦЪЧ_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
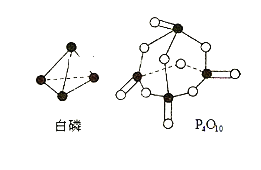
ЁОЬтФПЁПдкШчЭМЫљЪОЕФЮяжЪЯрЛЅзЊЛЏЙиЯЕжаЃЌAЪЧвЛжжЙЬЬхЕЅжЪЃЌEЪЧвЛжжАзЩЋВЛШмгкЫЎЕФЮяжЪЁЃОнДЫЬюПеЁЃ
ЃЈ1ЃЉаДГіИїЮяжЪЕФЛЏбЇЪНЃК
AЃЎ________ЁЂB________ЁЂC________ЁЂ
DЃЎ________ЁЂE________ЁЂF________ЁЃ
ЃЈ2ЃЉBгыaШмвКЗДгІЕФРызгЗНГЬЪНЪЧ_________ЁЃ
ЃЈ3ЃЉAгыaШмвКЗДгІЕФРызгЗНГЬЪНЪЧ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЮЭтЛюЖЏаЁзщЪеМЏСЫвЛжжКЯН№НјаавдЯТЬНОП(вбжЊЭдЊЫиЕФбцЩЋЗДгІГЪТЬЩЋ)ЁЃ
(1)ЭтЙлАЕЛвЩЋЃЌБэЦЄЙтЛЌЃЛ
(2)дкОЦОЋЕЦЭтбцЩЯзЦЩеЃЌЛ№бцГЪТЬЩЋЃЌКЯН№ЦЌШлЛЏЃЌЕЋВЛЕЮТфЃЛ
(3)ШЁЙЮШЅБэЦЄЕФКЯН№10 gЃЌЗХШызуСПЕФЯЁСђЫсжаЃЌЪеМЏЕНБъзМзДПіЯТЕФH2 8.96 LЃЛ
(4)СэШЁЙЮШЅБэЦЄЕФКЯН№10 gЃЌЗХШызуСПЕФNaOHШмвКжаЃЌвВЪеМЏЕНБъзМзДПіЯТЕФH2 8.96 LЁЃ
ЪдОнДЫХаЖЯЃЌИУКЯН№жавЛЖЈКЌгаЕФдЊЫиЪЧ________(аДдЊЫиЗћКХ)ЃЛПЩФмКЌгаЕФдЊЫиЪЧ________(ЬюбЁЯюБрКХ)ЁЃ
aЃЎAg bЃЎMg
cЃЎNa dЃЎFe
ШчЙћИУКЯН№жажЛКЌ2жждЊЫиЃЌдђЖўепЕФжЪСПБШЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПGЪЧКЯГЩФГаТаЭвЉЮяЕФжаМфЬхЃЌЯТЭМЪЧКЯГЩ GЕФВПЗжСїГЬЃК
вбжЊЃК

ввЫсєћЕФНсЙЙМђЪНЮЊ![]()
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)G жаКЌбѕЙйФмЭХЕФУћГЦЪЧ_______ЁЂ________ЁЃ
(2)ЗДгІ AЁњB ЕФЛЏбЇЗНГЬЪНЮЊ________________ЁЃ
(3)гаЛњЮя FЕФНсЙЙМђЪНЮЊ_________________ЁЃ
(4)ЗДгІ ЂмЁЂЂнЕФЗДгІРраЭЗжБ№ЪЧ_________ЁЂ___________ЁЃ
(5)аДГіТњзуЯТСаЬѕМўЕФ C ЕФЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН______________________ЁЃ
ЂёЃЎБНЛЗЩЯжЛгаСНжжШЁДњЛљ
ЂђЃЎЗжзгжажЛга 4 жжВЛЭЌЛЏбЇЛЗОГЕФЧтдзг
ЂѓЃЎФмгыNaHCO3ШмвКЗДгІЩњГЩ CO2
(6)вдввЫсєћКЭ![]() ЮЊдСЯЃЌжЦБИ
ЮЊдСЯЃЌжЦБИ![]() ЕФВПЗжСїГЬЭМШчЯТЁЃЧыНсКЯЯрЙиаХЯЂКЭвббЇжЊЪЖЃЌНЋКЯГЩТЗЯпВЙГфЭъећЃЈЮоЛњЪдМСШЮбЁЃЉЁЃ
ЕФВПЗжСїГЬЭМШчЯТЁЃЧыНсКЯЯрЙиаХЯЂКЭвббЇжЊЪЖЃЌНЋКЯГЩТЗЯпВЙГфЭъећЃЈЮоЛњЪдМСШЮбЁЃЉЁЃ
![]() ______________
______________
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com