
【题目】利用相关知识填空(NA代表阿伏伽德罗常数的数值)。
(1)标准状况下 11.2L NH3 中含_______个氨分子。
(2)物质的量相等的SO2 和 SO3 所含的氧原子数目之比为__________。
(3)4.8g CH4 中所含氢原子的物质的量为______________。
(4)12.4 g Na2R 含 Na+0.4 mol,则 Na2R 的摩尔质量为为_________________。
(5)标况下,一定量的 N2 与 22.4L CO 所含的分子数相等,则 N2 的质量为______。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
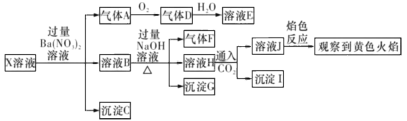
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
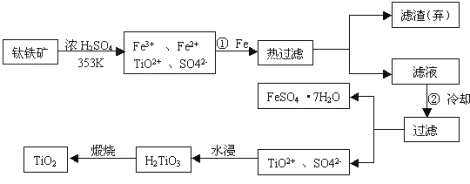
(1)Ti的原子序数为22,位于元素周期表中第_________周期第___________族。
(2)步骤①加铁的目的是___________________;步骤②冷却的目的是__________。
(3)写出流程中生成H2TiO3的离子方程式__________________________________。
(4)上述制备TiO2的过程中,考虑成本和废物综合利用因素,废液中应加入______处理。
(5)由金红石(TiO2 )制取单质Ti,涉及到的步骤为:TiO2→TiCl4![]() Ti
Ti
已知:① C(s) + O2 (g) = CO2 (g) ΔH = -393.5 kJmol-1
② 2CO(g) + O2 (g) = 2CO2(g) ΔH =-566 kJmol-1
③ TiO2 (s) + 2Cl2 (g) = TiCl4 (s) + O2 (g) ΔH = +141kJmol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) 的ΔH =___________。反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=______kJ·mol-1。
CH3OH(g) ΔH=______kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应速率的是________(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系
如右图所示。
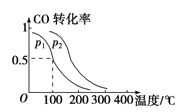
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________;
③在其他条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:_____________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式:_________________。
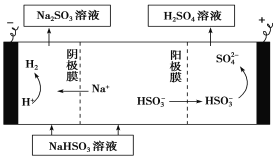
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算填空:
(1)2 mol尿素[CO(NH2)2]含_____________个H原子,所含氧原子跟__________g H2O所含氧原子个数相等。
(2)①标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是____________________。
(3)30.9 g NaR含有Na+0.3 mol,则NaR的摩尔质量为_________________。
(4)100mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol·L-1,则其中c(SO42-)=_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①下列实验装置一般用于什么实验操作(填实验操作名称)
A __________ B ___________ C ___________
A.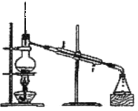 B.
B.![]() C.
C.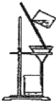
②将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是______。
(2)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的18.5倍,其中SO2的质量分数为 ________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为 ________。(小数点后保留1位)
(3)相同条件下,某Cl2与O2混合气体200 mL恰好与300 mL H2化合生成HCl和H2O(已知:H2+Cl2=2HCl),则混合气体中Cl2与O2的体积比为_____,混合气体的平均摩尔质量为_______________。(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O.
(1)该反应中发生还原反应的物质是________。氧化产物是________。
(2)用双线桥标出方程式中的电子得失2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O________
(3)当有0.2 mol电子发生转移时,生成的氯气的体积为________L (标准状况)。被氧化的HCl的物质的量为________mol.
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+) ③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
Ⅱ.已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
(1)配平并用“双线桥法”表示上述反应中电子转移的方向和数目:___Cu+___HNO3(稀) = ___Cu(NO3)2+___NO↑+___H2O。___________
(2)该反应中氧化剂与还原剂的物质的量之比为_______;写出该反应的离子方程式______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com