
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
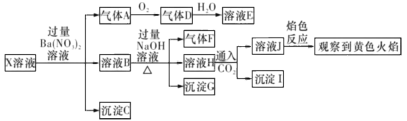
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
【答案】D
【解析】
①强酸性溶液中CO32、SO32不能存在;②X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O),在此反应中,Fe2+被氧化为Fe3+。③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3;说明有NH4+存在。④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,且前面加入的NaOH是过量的,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1;
A. 强酸性溶液X中CO32-、SO32-不能存在,故A错误.
B. 沉淀G为Fe(OH)3,但Fe3+可能是原来有的,也可能是Fe2+被氧化生成的,故B错误;
C. 溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,且前面加入的NaOH是过量的,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3,故C错误;
D. 溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色![]() 已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀
已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀![]() ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A.原溶液中的Br-一定被氧化
B.通入氯气之后原溶液中的Fe2+一定被氧化
C.溶液中一定不存在Fe2+
D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等。
(1)下列ΔH表示物质燃烧热的是_____(填ΔH1、ΔH2或ΔH3,下同);表示中和热的是____。
A. 2H2(g)+O2(g)=2H2O(l) ΔH1
B. C(s)+ O2(g)=CO(g) ΔH2
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3
D. C(s)+ O2(g)=CO2(g) ΔH4
E. C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=NaSO4(aq)+2H2O(l) ΔH7
(2)已知15g乙烷完全燃烧生成CO2和液态水,放热akJ,下列热化学方程式正确是(________)。
A. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=+2a kJ·mol-1
B. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=-2a kJ·mol-1
C. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=-4a kJ·mol-1
D. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=+4a kJ·mol-1
(3)充分燃烧一定量丁烷(C4H10)放出热量161.9kJ,且生成的CO2恰好能与2.5mol/L 100mL的氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出能量为__________。
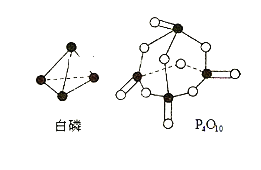
(4)进一步研究表明,化学反应能量变化与键能有关,键能简单理解断开1mol化学键吸收能量。下表是键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 197 | 360 | 499 | X |
已知白磷燃烧热为2378.0kJ·mol-1,则X=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL K2SO4和Al2(SO4)3的混合溶液,已知其中含Al3+1.08 g,SO42-6.72 g,则该溶液中K+的浓度为
A.0.1 mol/LB.0.15 mol/L
C.0.2 mol/LD.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备WS2的工艺流程如下图所示:
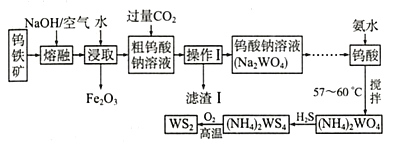
下列说法正确的是
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O
2Fe2O3+4Na2WO4+4H2O
C.已知(NH4)2WS4中W的化合价为+6,且2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,则生成124g WS2,该反应所转移的电子数目为2NA
2WS2+4NH3+2S+2SO2+2H2O,则生成124g WS2,该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定容积的密闭容器中发生反应H2(g)+I2(g)![]() 2HI(g),判断该反应达到平衡的标志是 ( )
2HI(g),判断该反应达到平衡的标志是 ( )
A. 混合气体的颜色不再改变B. H2、I2、HI的浓度相等
C. 混合气体的密度保持不变D. H2、I2、HI分子个数比为1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空(NA代表阿伏伽德罗常数的数值)。
(1)标准状况下 11.2L NH3 中含_______个氨分子。
(2)物质的量相等的SO2 和 SO3 所含的氧原子数目之比为__________。
(3)4.8g CH4 中所含氢原子的物质的量为______________。
(4)12.4 g Na2R 含 Na+0.4 mol,则 Na2R 的摩尔质量为为_________________。
(5)标况下,一定量的 N2 与 22.4L CO 所含的分子数相等,则 N2 的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com