
����Ŀ����84������Һ(��ҵ����Cl2��NaOH��Ӧ�Ƶã�������������Ư�ף�����ʵ������ķ�������ȷ����
ʵ����� |
|
|
|
ʵ������ | ��Ϻ���Һ��pH=9.9,��ʱ����δ��ɫ��һ��ʱ�����ɫ��ȥ�� | ��Ϻ���ҺpH=5.0����ɫѸ����ȥ������������� | ��Ϻ���ҺpH=3.2����ɫѸ����ȥ���������������壬ʹʪ��ĵ��۵⻯����ֽ������ |
A.�Ա�ʵ����������������ɫѸ����ȥ��ԭ���Ƿ����˷�ӦClO+H+�THClO
B.ʵ�����в�����������Cl2����HClO�ֽ�õ���2HClO�TCl2��+H2O
C.�Ա�ʵ������������Һ��pH���ܻ�Ӱ��ClO�������Ի�Cl�Ļ�ԭ��
D.������������84������Һ��Ư��Ч��������Ҫ���غ��ʵ�pH���ܰ�ȫʹ��
���𰸡�B
��������
A. ��84������Һ(��Ч�ɷ�ΪNaClO)��Һ�д����������ˮ����Һ�Լ��ԣ�ˮ�����ɵĴ��������Ư���ԣ���������ٽ�ˮ��ƽ��������У����ɴ�����Ũ�ȴ�Ư��Ч���죬������ɫѸ����ȥ��ԭ���Ƿ����˷�ӦClO+H+�THClO����A��ȷ��
B. ��84������Һ(��Ч�ɷ�ΪNaClO)��Һ�м���Ũ�Ƚϴ��ϡ���ᷴӦ����Ϻ���ҺpH=3.2����ɫѸ����ȥ���������������壬ʹʪ��ĵ��۵⻯����ֽ������˵���������������������Ӻʹ����������������Һ�з���������ԭ��Ӧ������������������ˮ��Ӧ���ɵĴ��������Ư���ԣ����ɵ���������ԣ���B����
C. �Ա�ʵ��ںۣ͢�����ҺŨ�ȴ�С��Ӱ�췴Ӧ���̣���Һ��pH���ܻ�Ӱ��ClO�������Ի�Cl�Ļ�ԭ�ԣ���C��ȷ��
D. ������������84������Һ��Ư��Ч���������Ũ�ȴ�ʱ��������Ⱦ������������Ҫ���غ��ʵ�pH���ܰ�ȫʹ�ã���D��ȷ��
��ѡB��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�����Դ���Ź㷺��Ӧ��ǰ����������Ȼ���Ʊ��������������¡�

��ش��������⣺
I��ת��������Ȼ��ѹ����������30��ʱ����T��F�������£����Ի������������ʾ��ͼ���¡�
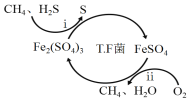
(1)����i�����ӷ�Ӧ����ʽΪ_________________________________________��
(2)��֪��
��Fe3+��pH=l.9ʱ��ʼ������pH=3.2ʱ������ȫ��
��30��ʱ����T.F�������£���ͬpH��FeSO4��Һ��Fe2+�������������±���
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+����������/g��L-1��h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
��ת�������У������ϱ���ѡ�����pH��Χ��_______<pH<_______������ѡ���ԭ���ǣ�_______________________________________________��
������ת�����ڴ����������£�ˮ������CH4�����������ͼ�ش����⡣
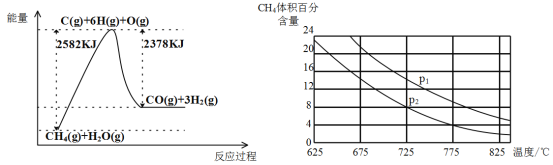
(3)�ٸù��̵��Ȼ�ѧ����ʽ��__________________________________________��
�ڱȽ�ѹǿP1��p2�Ĵ�С��ϵ��P1 _________ P2(ѡ����>����<������=��)��
����һ���¶Ⱥ�һ��ѹǿ�µ�����ɱ���ܱ������г���1molCH4��1mol��ˮ������ַ�Ӧ��ƽ������ʼʱ��������ܶ���ƽ��ʱ������ܶȵ�1.4��������ʱ���������Ϊ2L,��÷�Ӧ��ƽ�ⳣ��Ϊ______________(�������2λ��Ч����)��
����CO�任��500��ʱ��CO��һ����ˮ��Ӧ����CO2��H2��
����H2�ᴿ����CO2��H2����õ�H2�Ĺ�����ʾ��ͼ
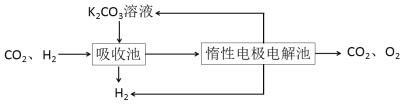
(4)���ճ��з�����Ӧ�����ӷ���ʽ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ���й�Ӧ�õ������У���ȷ����
A. �����ȼ����Ϊ890.3kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+ 2O2(g) �T CO2(g) + 2H2O(g) ��H = -890.3kJmol-1
B. ��֪ǿ����ǿ����ϡ��Һ�ﷴӦ���к���Ϊ57.3kJmol-1����![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)�T
Ba(OH)2(aq)�T![]() BaSO4(s)+H2O(l) ��H < -57.3kJmol-1
BaSO4(s)+H2O(l) ��H < -57.3kJmol-1
C. 500�桢30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g) + 3H2(g)![]() 2NH3(g) ��H = -38.6kJmol-1
2NH3(g) ��H = -38.6kJmol-1
D. ��֪25�桢101KPa�����£�4Al(s) + 3O2(g) �T 2A12O3(s) ��H = -2834.9kJmol-1��4Al(s) + 2O3(g) �T 2A12O3(s) ��H = -3119.1kJmol-1����O3��O2�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У�����1molN2��3molH2������һ���¶Ⱥ�ѹǿ�£�ʹ�䷢����Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H= -92.4 kJ��mol-1���ش��������⣺
2NH3(g) ��H= -92.4 kJ��mol-1���ش��������⣺
(1)�����������ݻ����䣬�������г���1molN2����Ӧ���ʻ�________(�����ӿ�������������������������ͬ)��������____________��
(2)�����������ݻ����䣬�������г���1molHe����Ӧ���ʻ�________��������________��
(3)����������������ѹǿ���䣬�������г���1molHe����Ӧ���ʻ�________��������___________��
(4)�����������Ӧ���ʻ�________��������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Fe��FeO��Fe3O4�Ļ�����м���100mL2mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�224mL����״���������壬������Һ�м���KSCN��Һ��Ѫ��ɫ���֡�����������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����ܵõ����������ǣ� ��
A. 11.2gB. 5.6gC. 2.8gD. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Warfarin)����ɱ���飬����ʳƷҩƷ�ල��������Ϊ��Ѫ�ܼ������ٴ�ҩ���ϳ�·��(���ַ�Ӧ������ȥ)������ʾ:
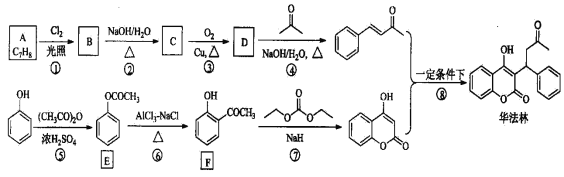
��ش���������:
��1��A������Ϊ_____________________��E�й���������Ϊ____________________��
��2��B�Ľṹ��ʽΪ___________________________��
��3����C����D�Ļ�ѧ����ʽΪ________________________________________��
��4���ݵķ�Ӧ����Ϊ____________����ķ�Ӧ����Ϊ_______________��
��5��F��ͬ���칹���У�ͬʱ��������������ͬ���칹�干��__________�֡�a������FeCl3��Һ������ɫ��Ӧ�� b���ܷ���������Ӧ�����к˴Ź�������Ϊ�����Ľṹ��ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǿ������ҺX�п��ܺ���Na+ �� K+��NH4+�� Fe3+��Fe2+��Al3+��CO32-�� SO32-��SO42-��C1-�������֣�ijͬѧΪ��ȷ����ɷ֣�ȡX��Һ������ ��ʵ�飬ʵ����̼�����������ʾ��
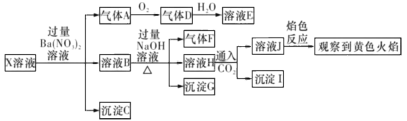
���н���ֹȷ����
A.����A��SO2��֤��ԭ��Һ�к���SO32-
B.����G�м��������ܽ⣬�μ�KSCN��Һ�Ժ�ɫ������ȷ��ԭ��Һ�� ��Fe3+
C.����I�D����A1(OH)3
D.X�в���ȷ����������Al3+��Fe3+ ��Na+ ��K +��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѣ�Ti������Ϊ��������֮��ĵ����������Ѱף�TiO2����Ŀǰ��õİ�ɫ���ϡ��Ʊ�TiO2��Ti��ԭ�����������ҹ�������������������λ������Fe2O3����������Ҫ�ɷ�ΪFeTiO3����ȡTiO2���������£�
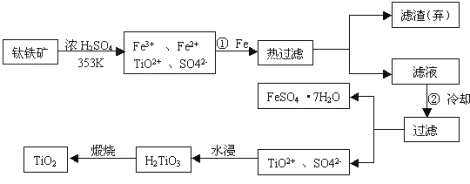
��1��Ti��ԭ������Ϊ22��λ��Ԫ�����ڱ��е�_________���ڵ�___________�塣
��2��������������Ŀ����___________________���������ȴ��Ŀ����__________��
��3��д������������H2TiO3�����ӷ���ʽ__________________________________��
��4�������Ʊ�TiO2�Ĺ����У����dzɱ��ͷ����ۺ��������أ���Һ��Ӧ����______������
��5���ɽ��ʯ(TiO2 )��ȡ����Ti���漰���IJ���Ϊ��TiO2��TiCl4![]() Ti
Ti
��֪���� C(s) + O2 (g) = CO2 (g) ��H = ��393.5 kJmol-1
�� 2CO(g) + O2 (g) = 2CO2(g) ��H =��566 kJmol-1
�� TiO2 (s) + 2Cl2 (g) = TiCl4 (s) + O2 (g) ��H = +141kJmol-1
��TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) ����H =___________����ӦTiCl4+2Mg=2MgCl2+Ti��Ar�����н��е�������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ʵ��װ��һ������ʲôʵ���������ʵ��������ƣ�
A __________ B ___________ C ___________
A��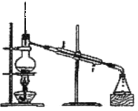 B��
B��![]() C��
C��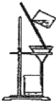
����3p%��������ͬ�����p%�������ϵõ�q%��ϡ���ᣬ��p��q�Ĺ�ϵ��ȷ����______��
��2����ͬ�¡�ͬѹ�£�ʵ����CO��N2��SO2��������Ļ��������ܶ���H2��18.5��������SO2����������Ϊ ________��������CO��N2�����ʵ���֮��Ϊ1��1��������������Ԫ�ص���������Ϊ ________����С�������1λ��
��3����ͬ�����£�ijCl2��O2�������200 mLǡ����300 mL H2��������HCl��H2O����֪��H2+Cl2=2HCl��������������Cl2��O2�������Ϊ_____����������ƽ��Ħ������Ϊ_______________����С�������1λ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com