
【题目】在一密闭容器中,充入1molN2和3molH2,并在一定温度和压强下,使其发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
(1)若保持容器容积不变,再向其中充入1molN2,反应速率会________(填“加快”“减慢”或“不变”,下同),理由是____________。
(2)若保持容器容积不变,再向其中充入1molHe,反应速率会________,理由是________。
(3)若保持容器内气体压强不变,再向其中充入1molHe,反应速率会________,理由是___________。
(4)加入催化剂,反应速率会________,理由是______________________________。
【答案】加快 反应物浓度变大 不变 反应物浓度不变 减慢 体积变大导致反应物浓度减小 加快 降低了反应的活化能
【解析】
根据影响化学反应速率的因素分析判断
(1)若保持容器体积不变,再向其中充入1molN2,氮气的浓度增大,反应速率加快,故答案为:加快;增大了反应物的浓度,反应速率加快;
(2)若保持容器体积不变,再向其中充入1mol氩气,反应物的浓度不变,反应速率不变,故答案为:不变;反应物的浓度不变;
(3)若保持容器气体压强不变,再向其中充入1molHe,气体体积和气体的物质的量成正比,容器的体积增大,反应物和生成物的浓度均减小,反应速率减慢,故答案为:减慢;体积变大导致反应物浓度减小;
(4)使用催化剂,反应速率会加快,因催化剂可以降低反应的活化能,提高活化分子的百分数,反应速率加快,故答案为:加快;催化剂可以降低反应的活化能。


科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 gcm﹣3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 molL﹣1的硫酸。
(1)需要量取该浓硫酸的体积为_______mL。
(2)实验需要以下步骤:
①定容 ②量取 ③摇匀 ④洗涤 ⑤转移 ⑥冷却 ⑦计算 ⑧装瓶 ⑨稀释
进行顺序为_______。
(3)下列操作使所配溶液的物质的量浓度偏高的是________。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等。
(1)下列ΔH表示物质燃烧热的是_____(填ΔH1、ΔH2或ΔH3,下同);表示中和热的是____。
A. 2H2(g)+O2(g)=2H2O(l) ΔH1
B. C(s)+ O2(g)=CO(g) ΔH2
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3
D. C(s)+ O2(g)=CO2(g) ΔH4
E. C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=NaSO4(aq)+2H2O(l) ΔH7
(2)已知15g乙烷完全燃烧生成CO2和液态水,放热akJ,下列热化学方程式正确是(________)。
A. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=+2a kJ·mol-1
B. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=-2a kJ·mol-1
C. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=-4a kJ·mol-1
D. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=+4a kJ·mol-1
(3)充分燃烧一定量丁烷(C4H10)放出热量161.9kJ,且生成的CO2恰好能与2.5mol/L 100mL的氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出能量为__________。
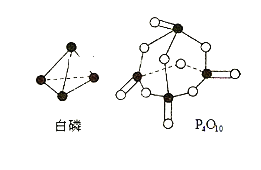
(4)进一步研究表明,化学反应能量变化与键能有关,键能简单理解断开1mol化学键吸收能量。下表是键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 197 | 360 | 499 | X |
已知白磷燃烧热为2378.0kJ·mol-1,则X=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ΔH2 = bkJ mol-1
其他数据如下表所示,下列说法正确的是
化学键 | C=O | C—H | O—H | O=O |
键能/(kJ mol-1) | 798 | 413 | 463 | x |
A.ΔH1 < ΔH2
B.H2O(g) = H2O(1) ΔH=(a-b)kJ mol -1
C.当有4NA个O-H键生成时,反应放出的热量为a kJ
D.上文中x =![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备WS2的工艺流程如下图所示:
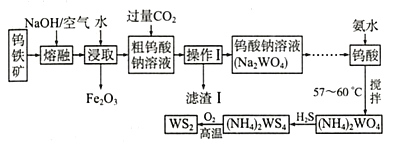
下列说法正确的是
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O
2Fe2O3+4Na2WO4+4H2O
C.已知(NH4)2WS4中W的化合价为+6,且2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,则生成124g WS2,该反应所转移的电子数目为2NA
2WS2+4NH3+2S+2SO2+2H2O,则生成124g WS2,该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
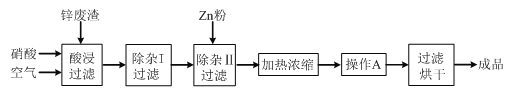
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是_____________________。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有_____。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为_____。检验Fe3+是否沉淀完全的实验操作是_____。
⑷加入Zn粉的作用是_____。“操作A”的名称是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com