
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
【答案】C
【解析】
A.金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的方程式为:Zn+CuSO4=ZnSO4+Cu,使溶液的蓝色消失,A项正确;
B. 澄清石灰水久置以后会与空气中的二氧化碳反应而生产碳酸钙白色沉淀,其反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,B项正确;
C. 过氧化钠在空气中放置,会与空气中的水蒸气及二氧化碳发生反应,最终生成白色且稳定的碳酸钠,涉及的转化关系有:Na2O2→NaOH→Na2CO3·10H2O→Na2CO3,C项错误;
D.向氢氧化镁悬浊液中滴加足量氯化铁溶液,会发生沉淀的转化,化学方程式为:3Mg(OH)2 + 2FeCl3= 2Fe(OH)3+ 3MgCl2,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】向两份30mL同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
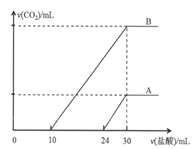
请回答下列问题:
(1)M溶液中溶质为(写化学式)___________,其物质的量之比是__________。
(2)N溶液溶质为(写化学式)____________,标准状况下CO2气体的体积为________,原NaOH溶液的物质的量浓度为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1molL﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
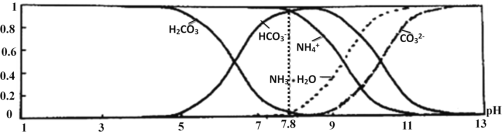
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3H2O)>Ka1(H2CO3)
B. 0.1 molL-1 NH4HCO3溶液中存在:c(NH3H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)
Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用______![]() 填仪器名称
填仪器名称![]() 量取10.00mL市售白醋,在烧杯中用水稀释后转移到______
量取10.00mL市售白醋,在烧杯中用水稀释后转移到______![]() 填仪器容量、名称
填仪器容量、名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂.
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数:如果液面位置如图所示,则此时的读数为______mL.
![]()
(4)滴定:当________________________________________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) |
|
|
|
|
V(NaOH)(消耗) |
|
|
|
|
Ⅲ.数据处理与讨论
(5)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积:V=![]() =15.24mL指出他的计算的不合理之处:_________________________________________________。
=15.24mL指出他的计算的不合理之处:_________________________________________________。
选取正确数据,可得![]() 市售白醋
市售白醋![]() ____mol/L;市售白醋总酸量
____mol/L;市售白醋总酸量![]() ____g/100mL。
____g/100mL。
(6)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填标号).
A.pHB.电离度C.电离常数D.溶解度
(7)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填标号).
A.碱式滴定管在用蒸馏水洗净后,未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )

A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:

物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
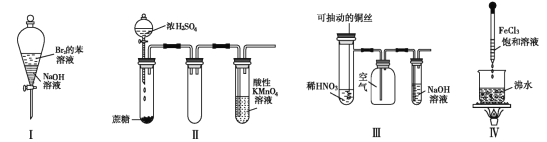
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com