
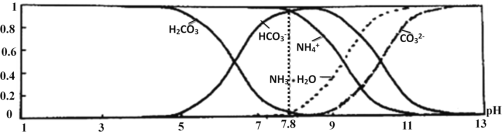
【题目】常温下,现有0.1molL﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3H2O)>Ka1(H2CO3)
B. 0.1 molL-1 NH4HCO3溶液中存在:c(NH3H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
【答案】D
【解析】
A. 碳酸氢钠溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小。
B. 根据碳酸氢铵溶液中的物料守恒分析;
C. 当pH=9时,结合图象判断溶液中各离子浓度大小;
D. 该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;
A. 由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则Kb(NH3H2O)>Ka1(H2CO3),故A项正确;
B. 0.1mol/L的NH4HCO3溶液的pH=7.8,由图像可知,c(NH4+) = c(HCO3),又NH4HCO3溶液中存在物料守恒:c(NH4+)+ c(NH3H2O) = c(HCO3)+ c(CO32-)+ c(H2CO3),联立两式可知,c(NH3H2O)=c(H2CO3)+c(CO32-),故B项正确;
C. 结合图象可知,溶液的pH = 9时,溶液中离子浓度大小为: c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-),故C项正确;
D. 0.1mol/L的NH4HCO3溶液的pH=7.8,结合图像及反应原理可知,当逐滴滴加氢氧化钠溶液时,铵根离子会与氢氧根离子发生反应生成一水合氨,其浓度逐渐减小;而碳酸氢根离子由于水解显碱性,当加入氢氧化钠溶液后,开始由于抑制碳酸氢根离子的水解而使其离子浓度会先略增大,而后发生反应:HCO3- + OH- = CO32- + H2O,则使得HCO3-浓度大大减小,故D项错误;
答案选D。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下所示4个装置图,以下说法中正确的是

A. ①装置可用于比较NaHCO3和Na2CO3的稳定性 B. 用酒精萃取溴水中的溴可选择②装置
C. 如③装置进行实验可看到酸性KMnO4溶液褪色 D. ④装置可用于实验室制取并收集少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是
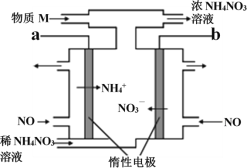
A. a 应接直流电源的正极
B. 补充的物质M是NH3
C. 阳极的电极反应式: NO+5e-+6H+=NH4++H2O
D. 电路中通过5mol 电子时,理论上最多可处理22.4L NO气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
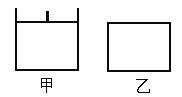
A. 平衡时NO2体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根、酸根离子)的组成分数如图所示。下列说法正确的是

A. HX-的电离程度小于水解程度
B. 在pH=7的溶液中HX-和X2-能大量共存
C. 在pH=9时,H2X 与NaOH恰好完全中和
D. 1L.0.1 molL-1Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验,能达到实验目的的是( )
A.  证明稳定性:Na2CO3>NaHCO3
证明稳定性:Na2CO3>NaHCO3
B.  证明非金属性:Cl>Br>I
证明非金属性:Cl>Br>I
C.  验证镁和盐酸反应的热效应
验证镁和盐酸反应的热效应
D. 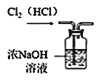 除去 Cl2 中的杂质气体 HCl
除去 Cl2 中的杂质气体 HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com