
����Ŀ��1915��ŵ��������ѧ������Henry Bragg��Lawrence Bragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ף�
(1)��ѧ��ͨ��X����̽����NaCl��KCl��MgO��CaO����ṹ���ƣ��������־���ľ������������±���

4�־���NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳����__��
(2)��ѧ��ͨ��X�����Ʋ���мȺ�����λ�����ֺ����������ṹʾ��ͼ�ɼ�ʾ���£�������λ����������������߱�ʾ��

��д����̬Cuԭ�ӵĺ�������Ų�ʽ__������ͭ��������__������ĸ���ţ��ѻ���ʽ��

��д������������ˮ��ͭ���ӵĽṹ��ʽ�����뽫��λ����ʾ������__��
��ˮ���Ӽ��������������о�������ʵ˵�������ˮ�����ʵ�Ӱ��__��
��SO42���Ŀռ乹����________��
���𰸡�MgO��CaO��NaCl��KCl 1s22s22p63s23p63d104s1 C  ˮ���ۡ��е�ϸߣ����ʱ�ܶȼ�С ��������
ˮ���ۡ��е�ϸߣ����ʱ�ܶȼ�С ��������
��������
(1)Ӱ�쾧�徧���ܴ�С�����������Ӱ뾶�Լ�����������ɵĶ��٣�������Խ���۵�Խ����
(2)��Cu��ԭ������Ϊ29������������ԭ���ͺ��ع����������д�����Ų�ʽ��CuΪ���������ܶѻ���
��Cu2+�ṩ�չ����ˮ����ԭ���ṩ�µ��Ӷԣ��γ���λ����
�������һ����Ӽ�������ǿ��Ӱ�����ʵ�����������
������Sԭ�Ӽ۲���Ӷ�����µ��Ӷ���,�ж�SO42-�Ŀռ�ṹ��
(1)���Ӱ뾶Mg2+<Na+<O2-<Ca2+ <Cl-�����ӵ����Na+= Cl-< O2-= Mg2+= Ca2+�����Ӿ�������Ӱ뾶ԽС���������Խ�࣬������Խ��������۷е�Խ��,����NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳����MgO��CaO��NaCl��KCl��
��ȷ����MgO��CaO��NaCl��KCl��
(2)��Cu��ԭ������Ϊ29�������Ų�ʽΪ1s22s22p63s23p63d104s1��CuΪ���������ܶѻ�����λ��Ϊ12����C������
��ȷ����1s22s22p63s23p63d104s1 ��C��
��Cu2+�ṩ�չ����ˮ����ԭ���ṩ�µ��Ӷԣ��γ���λ����ˮ��ͭ���ӵĽṹ��ʽΪ��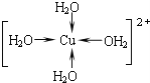 ��
��
��ȷ����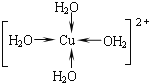 ��
��
�������һ����Ӽ�������ǿ������ˮ���ۡ��е�ϸߣ���Ϊ������з����ԣ����ʱ��������࣬��������ܶȼ�С��
��ȷ����ˮ���ۡ��е�ϸߣ����ʱ�ܶȼ�С��
��SO42������ԭ��S�ļ۲���Ӷ���=4+![]() =4���µ��Ӷ���Ϊ0��Ϊ��������ṹ��
=4���µ��Ӷ���Ϊ0��Ϊ��������ṹ��
��ȷ��������������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�߷��ӻ�����I���Ṥҵ��������Ҫԭ�ϣ�����һ�������ϳ�·�����£�

��֪��
�ش��������⣺
��1��AΪ��������A�Ļ�ѧ������______��
��2��G��H��H��I�ķ�Ӧ���ͷֱ���______��______��
��3����G�ṹΪ 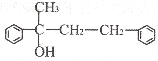
����д��D�Ľṹ��ʽ______��
��2��B����C�Ļ�ѧ����ʽΪ__��
��4��C�ж���ͬ���칹�壬�������ڷ����ͬ���칹����_____�֣�д�����о�������˴Ź��������һ�ֽṹ��ʽ_____��
��5���ο������ϳ�·����Ϣ��д����CH3��CH=CH2��CH3MgBrΪԭ��(����������ѡ)�ϳ� �ĺϳ�·��ͼ��_____
�ĺϳ�·��ͼ��_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���42��XԪ��ԭ�ӵ�4p�������3��δ�ɶԵ��ӣ�YԪ��ԭ�ӵ������2p�������2��δ�ɶԵ��ӡ�X��Y���γɻ�����X2Y3��ZԪ�ؿ����γɸ�һ�����ӡ���ش��������⣺
��1��XԪ��ԭ�ӻ�̬ʱ�ĵ����Ų�ʽΪ__________����Ԫ�صķ�����__________;
 ��2��YԪ��ԭ�ӵļ۲���ӵĹ����ʾʽΪ________����Ԫ�ص�������__________;
��2��YԪ��ԭ�ӵļ۲���ӵĹ����ʾʽΪ________����Ԫ�ص�������__________;
��3��X��Z���γɻ�����XZ3���û�����Ŀռ乹��Ϊ____________;
��4����֪������X2Y3��ϡ������Һ�пɱ�����п��ԭΪXZ3�����ﻹ��ZnSO4��H2O���÷�Ӧ�Ļ�ѧ����ʽ��_________________________________________________;
��5���Ƚ�X���⻯����ͬ��ڶ�����������Ԫ�����γɵ��⻯���ȶ��ԡ��е�ߵͲ�˵������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�������������У��뾶���ɴ�С������˳����____________(�����)��
�ٻ�̬X��ԭ�ӽṹʾ��ͼ��![]()
�ڻ�̬Y�ļ۵����Ų�ʽ��3s23p5
�ۻ�̬Z2���ĵ����Ų�ͼ��![]()
��W��̬ԭ����2���ܲ㣬����ʽΪ![]()
(2)��֪An����B(n��1)����Cn����D(n��1)����������ͬ�ĵ��Ӳ�ṹ����A��B��C��D��ԭ�Ӱ뾶�ɴ�С��˳����______________�����Ӱ뾶�ɴ�С��˳����________________��ԭ�������ɴ�С��˳����__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. �������Ƶ���ˮʱ����Һ��pH��С
B. �Ӵ�����ʹN2��H2��һ��������ת��ΪNH3
C. ����Fe3+��Cu2+����Һ�м���CuOʹFe3+����Fe(OH)3����
D. ����ѹǿ��������SO2��O2��Ӧ����SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����������M�Է��ѻ�ù���нϺõ��־����ԣ���ϳ�·������ͼ��ʾ��

��֪��
�ش��������⣺
��1��������C�еĺ�������������Ϊ_________��A��B�ķ�Ӧ����Ϊ__________��
��2��A������Ϊ____________
��3��д��D�Ľṹ��ʽ��_____________________________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ��____________________________________________��
��5��������C��������������ͬ���칹����_______�֣�д������һ����5�ֲ�ͬ������ԭ�ӵ�ͬ���칹��Ľṹ��ʽ��_______________��
�ٺ������ṹ�����ڼ��������·���ˮ�⣻
������FeCl3������ɫ��Ӧ��
���ܷ���������Ӧ��
��6����֪CH3CH2CN![]() CH3CH2COOH������
CH3CH2COOH������ ��CH2=CHCN���Ҵ�Ϊԭ�Ϻϳɻ�����
��CH2=CHCN���Ҵ�Ϊԭ�Ϻϳɻ�����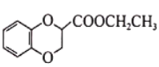 ��д���Ʊ��ĺϳ�·������ͼ�����Լ����ã�____________________
��д���Ʊ��ĺϳ�·������ͼ�����Լ����ã�____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ����������п�����������ʣ��ľ���ԭ����������װ����XΪ�����ӽ���Ĥ���ش��������⣺

(1)����ȼ�ϵ�ظ����ĵ缫��ӦʽΪ_________��
(2)��װ����������ͨ��XĤ��________ �����Fe����C�����ƶ�����װ���д�ͭΪ_______�缫���A����B����
(3)���ڱ���£���2.24L�������뷴Ӧ������װ�����Ҳ���Һ________������ӡ����١���______g����װ����CuSO4Ũ��__________������ӡ��������١� ���䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������İ�ˮ�ӵ�����ͭ��Һ�У���Һ���ձ������ɫ�����������Ҵ�����������ɫ�ľ���[Cu(NH3)4]SO4��H2O��
(1)Cu2+�۵����Ų�ʽΪ___________��[Cu(NH3)4]SO4��H2O�У�1mol[Cu(NH3)4]2+���ЦҼ�����ĿΪ___________��
(2)SO42����Sԭ�ӹ���ӻ�����Ϊ___________��H3O+���ι���Ϊ___________��
(3)NH3��������H2O�У����ܵ�ԭ��Ϊ___________��
(4)N��O��S��һ�������ɴ�С��˳��Ϊ___________��

(5)Cu��F�γɵĻ�����ľ����ṹ��ͼ��ʾ���������ܶ�Ϊag��cm��3����Cu��F�������Ϊ___________pm(��NA��ʾ�����ӵ�������ֵ���г��������ʽ�����û���)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com