
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含有少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。回答下列问题:

(1)甲烷燃料电池负极的电极反应式为_________。
(2)乙装置中阳离子通过X膜向________ 极(填“Fe”或“C”)移动;丙装置中粗铜为_______电极(填“A”或“B”)
(3)若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液________(填“增加”或“减少”)______g,丙装置中CuSO4浓度__________(填“增加”、“减少” 或“不变”)。
【答案】CH4 - 8e- +10OH- =CO32- +7H2O Fe B 减少 23.4 减少
【解析】
(1)燃料电池是将化学能转化为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极。
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳离子通过X膜向阴极移动,粗铜作阳极。
(3)根据串联电池中转移电子数相等得氧气和氯气的关系式为:O2~2Cl2。
(1)燃料电池是将化学能转化为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4 - 8e- +10OH- =CO32- +7H2O,故答案为:CH4 - 8e- +10OH- =CO32- +7H2O。
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳离子通过X膜向阴极移动,粗铜作阳极,故答案为:Fe;B。
(3)根据串联电池中转移电子数相等得氧气和氯气的关系式为:O2~2Cl2,标况下,2.24L氧气的物质的量为0.1mol,所以氯气的物质的量为0.2mol,消耗溶液中氯离子为0.4mol,乙装置中阳离子交换膜右侧进入左侧的钠离子也为0.4mol,所以右侧溶液质量减少为0.4×23+0.4×35.5=23.4g,粗铜(含有少量锌、金、银等杂质),阳极上不仅铜还有锌失电子进入溶液中,阴极上析出铜,根据转移电子数相等,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中CuSO4浓度减小,故答案为:减少 ;23.4 ;减少。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B均为钾盐的水溶液,A呈中性,B有氧化性,E的溶质中有一种含+5价元素的含氧酸盐M。现有下图所示转化:
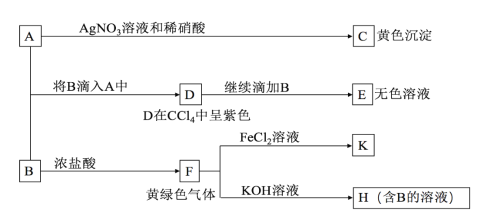
请回答:
(1)C的化学式为_________,检验气体F常用的试纸是______________
(2)写出物质M在生活中的常见用途______________
(3)写出F→H的化学方程式:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中发生反应N2O4(g)![]() 2NO2(g) ΔH>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的_____。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用。。。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)_____。其中②中的操作中。。。处填“改用________。”
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会影响所配溶液的浓度(填“偏高”、“偏低”或“无影响”)
①用天平(不使用游码)称量时,被称量物与砝码的位置放颠倒了____
②用量筒量取液体溶质,读数时俯视量筒,所配溶液的浓度____
③用胶头滴管定容时,仰视刻度线,所配溶液的浓度____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2A(g)![]() B(g)+C(s) ΔH>0,若0~15 s内c(A)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
B(g)+C(s) ΔH>0,若0~15 s内c(A)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用C表示的平均反应速率为v(C)=0.001 mol·L-1·s-1
B. 0~15 s内v(B)=0.002 mol·L-1·s-1
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号

②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于置换反应的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
B.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3 +3CO![]() 2Fe+3CO2
2Fe+3CO2
D.2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com