
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号

②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

【答案】1s22s22p63s23p63d8 d sp3 Ⅰ 三角锥 SO32- 是 是 正八面体 5.2
【解析】
(1)Ni2+基态原子的核外电子排布为1s22s22p63s23p63d8,铬元素在周期表中d区。
(2)聚硅氧烷中C形成4个单键;
(3)①根据第一电离能分析,第一电离能越小,越容易生成较稳定的单核阳离子;
②根据VSEPR理论判断ClO3-的空间构型,价电子对数为VP=BP+LP,等电子体是指原子总数相同,价电子总数也相同的微粒;
(4)根据O2-的坐标分析,根据晶胞粒子的排布,该立方体是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,根据密度公式ρ=m/V计算。
(1)Ni2+基态原子的核外电子排布为1s22s22p63s23p63d8,铬元素在周期表中d区。
(2)聚硅氧烷中C形成4个单键,所以C的杂化方式为sp3;
(3)①根据第一电离能分析,第一电离能越小,越容易生成较稳定的单核阳离子,所以有可能生成较稳定的单核阳离子的卤素原子是:I;
②根据VSEPR理论判断ClO3-的空间构型,价电子对数为VP=BP+LP=3+(7-2×3+1)/2=4,VSEPR模型为四面体形,由于一对孤电子对占据四面体的一个顶点,所以其空间构型为三角锥形,
等电子体是指原子总数相同,价电子总数也相同的微粒,则与ClO3-互为等电子体的是SO32-;
(4)晶胞中,O2-的坐标为(1/2,0,0),(0,1/2,0),(0,0,1/2),(1/2,1/2,1/2),将(1/2,1/2,1/2)+(1/2,1/2,0)=(0,0,1/2),将(1/2,1/2,1/2)+(0,1/2,1/2)=(1/2,0,0),将(1/2,1/2,1/2)+(1/2,0,1/2)=(0,1/2,0),刚好与前三个坐标相同,所以O2-做面心立方最密堆积,根据晶胞粒子的排布,该立方体是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,以立方体计算,1个立方体中含有Fe3+的个数为4×1/8+1/2×3=2个,含有Fe2+的个数为1个,含有O2-的个数为12×1/4+1=4个,不妨取1mol这样的立方体,即有NA个这样的立方体,1mol立方体的质量为m=(56×3+16×4)g,1个立方体体积为V=a3nm3=a3(a×10-7)3cm3,则晶体密度为ρ=m/NAV=(56×3+16×4)/(6.02×1023)×(0.42×10-7)3g·cm-3=5.2g·cm-3。


科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。工业上用钛铁矿(主要成分为钛酸亚铁FeTiO3,含FeO、Fe2O3、SiO2)为原料制TiO2,再由TiO2制得金属Ti

资料:TiO2+会发生水解
(1)步骤②、③、④中,均需用到的操作是_______。(填操作名称)
(2)检验滤液2中是否含Fe3+的方法是:_______。
(3)步骤1中FeTiO3溶于过量硫酸的化学方程式___________。

(4)请结合化学用语解释步骤④中加热水的原因___________。
(5)电解法获得Ti是通过图装置,以熔融CaCl2做电解质
①a为电源的_____(填“正”或“负”)
②在制备钛的过程中石墨电极附近的气泡中除了O2、CO、CO2外还可能有的气体是______________,用化学用语解释原因________________。
(6)测定废液中Fe2+浓度已确认铁元素的回收率:取25.00ml废液于锥形瓶中,用硫酸酸化的xmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积如图所示:
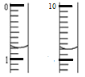
(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O).废液中c(Fe2+)=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子数之比为___;氧原子数之比为____;相同条件下的体积之比为____。
(2)标准状况下,1.7gNH3与标准状况下___LH2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为____,R的相对原子质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
)广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
PC塑料( ![]() )的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
)的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:

已知:①RCOOR1 + R2OH ![]() RCOOR2 + R1OH
RCOOR2 + R1OH
②B、F、G、H、J各物质中,核磁共振氢谱都只有一组吸收峰。
(1)B的结构简式:_______________。
(2)A→D的反应类型:_______________。
(3)D→E的反应条件:_______________。
(4)E中官能团名称:_______________。
(5)E→F的化学方程式:_______________。
(6)H的结构简式:_______________。
(7)反应II的化学方程式:_______________。
(8)下列说法正确的是:_______________。
a、反应I的原子利用率为100%
b、1mol J与足量的NaOH溶液反应,消耗2molNaOH
c、CH3OH在合成PC塑料过程中可以循环利用
(9)反应I过程中,可以得到两种同类型副产物,且与M互为同分异构体,请写出其中一种结构:_______________。
(10)A ![]() N
N ![]() 苯酚+F,试推断N的结构:_______________
苯酚+F,试推断N的结构:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01molL-1 CH3COOH溶液中逐滴加入0.01molL-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是

A. a点溶液中c(H+)为4.0×10-5mol/L
B. c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-)
C. V=20
D. a、b、c三点中水的电离程度最大的是c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 14.2g C10H22中含有共价键总数为3.1NA
C. 标准状况下,将3.36L Cl2通入1L 0.2mol/L FeBr2溶液中,被氧化的Br-数目为0.3NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜、铟、镓、硒等化合物。
(1)镓的基态原子的价电子排布式是___________。
(2)已知硒为第4周期ⅥA族元素,则硒与其相邻的同周期元素中,第一电离能从大到小顺序为___(用元素符号表示)。
(3)气态SeO3分子的立体构型为_____________________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为______;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为_______;
(7)一种铜金合金晶体具有面心立方最密堆积的结构.在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为______,若Au的原子半径为a pm,Cu的原子半径为b pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列10种物质:①盐酸 ②石墨 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 溶液 ⑦酒精 ⑧NaHCO3 ⑨CO2 ⑩Na2CO310H2O。其中,属于非电解质有___,属于电解质的____。
(2)下列方程式中属于氧化还原反应的是___。
①2H2+O2![]() 2H2O ②CuO+H2
2H2O ②CuO+H2![]() Cu+H2O
Cu+H2O
③NH4HCO3![]() NH3↑+H2O↑+CO2↑ ④2CO+O2
NH3↑+H2O↑+CO2↑ ④2CO+O2![]() 2CO2
2CO2
⑤H2O(g)+C![]() H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
(3)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则A的相对原子质量=___。
(4)写出NaHCO3的电离方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com