
【题目】金属钛在航天、潜海和医疗方面应用广泛。工业上用钛铁矿(主要成分为钛酸亚铁FeTiO3,含FeO、Fe2O3、SiO2)为原料制TiO2,再由TiO2制得金属Ti

资料:TiO2+会发生水解
(1)步骤②、③、④中,均需用到的操作是_______。(填操作名称)
(2)检验滤液2中是否含Fe3+的方法是:_______。
(3)步骤1中FeTiO3溶于过量硫酸的化学方程式___________。

(4)请结合化学用语解释步骤④中加热水的原因___________。
(5)电解法获得Ti是通过图装置,以熔融CaCl2做电解质
①a为电源的_____(填“正”或“负”)
②在制备钛的过程中石墨电极附近的气泡中除了O2、CO、CO2外还可能有的气体是______________,用化学用语解释原因________________。
(6)测定废液中Fe2+浓度已确认铁元素的回收率:取25.00ml废液于锥形瓶中,用硫酸酸化的xmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积如图所示:
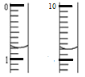
(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O).废液中c(Fe2+)=_________
【答案】过滤 取1—2mL滤液2,滴加KSCN溶液,变红,有Fe3+ FeTiO3 + 2H2SO4 = FeSO4 + TiOSO4 + 2H2O TiO2+ + 2H2O![]() H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行 负 Cl2 2Cl-— 2e-= Cl2↑ 2xmolL—1
H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行 负 Cl2 2Cl-— 2e-= Cl2↑ 2xmolL—1
【解析】
钛铁矿(主要成分为钛酸亚铁FeTiO3,含FeO、Fe2O3、SiO2)在353K时用硫酸溶解,FeTiO3、FeO和Fe2O3溶于硫酸生成硫酸铁、硫酸亚铁和TiOSO4,二氧化硅不溶,过滤除去;滤液1中加入过量铁粉,将Fe3+还原为Fe2+,过滤出不溶性物质,得到滤液2,经冷却结晶得到硫酸亚铁晶体,过滤后得滤液3,滤液3中含有TiOSO4加入热水促进水解经过滤得到H2TiO3固体,煅烧H2TiO3制TiO2,TiO2通过电解得到Ti。
(1) 步骤②、③、④操作过程中都得到沉淀或晶体,故需要过滤操作得到固体和溶液,
故答案为:过滤;
(2)检验Fe3+的方法是:取1—2mL滤液2,滴加KSCN溶液,变红,说明有Fe3+,
故答案为:取1—2mL滤液2,滴加KSCN溶液,变红,有Fe3+;
(3)由流程图可知,步骤1中FeTiO3溶于过量硫酸生成TiOSO4、FeSO4和水,化学方程式为:FeTiO3 + 2H2SO4 = FeSO4 + TiOSO4 + 2H2O;
(4) TiO2+在溶液中水解,溶液中存在平衡:TiO2+ + 2H2O![]() H2TiO3 + 2H+,水解反应一般为吸热反应,当加入热水,稀释、升温平衡正向移动,有利于生成H2TiO3。
H2TiO3 + 2H+,水解反应一般为吸热反应,当加入热水,稀释、升温平衡正向移动,有利于生成H2TiO3。
故答案为:TiO2+ + 2H2O![]() H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行;
H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行;
(5)①由图可知,制取Ti,用石墨作阳极、TiO2作阴极、熔融CaCl2作电解质,阳极发生氧化反应,阴极发生还原反应,电解池的阴极要与电源的负极连接,故a为电源的负极,
故答案为:负极;
②由图示阳极产物可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳或一氧化碳,同时氯离子也可以失电子生成氯气,电极反应为:2Cl-— 2e-= Cl2↑,
故答案为:2Cl-— 2e- = Cl2↑;
(6)由图可知滴定管的初读数为0.80mL,末读数为10.80mL,所以滴定时消耗KMnO4溶液体积为:10.80mL-0.80mL=10.00mL,
根据滴定时发生反应的离子方程式: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
n(Fe2+)=5n(MnO4-)=5×xmol/L×0.01L=0.05xmol,
所以c(Fe2+)= ![]() =2xmolL—1,
=2xmolL—1,
故答案为:2xmolL—1。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积、体积为2 L的密闭容器中充入1 mol N2和3 mol H2发生反应,当反应进行到10 s末时反应达到平衡,此时容器中c(NH3)=0.1mol·L-1。下列有关判断错误的是
A.反应达平衡时N2的转化率为10%
B.反应进行到10 s末时,H2的平均反应速率是0.03 mol·(L·s)-1
C.该反应达到平衡时,N2的平衡浓度为0.45 mol/L
D.该反应达到平衡时的压强是起始时压强的0.95倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述正确的是
A. 二氧化硫能使紫色石蕊溶液变红但不褪色B. 氯水久置后,漂白性和酸性均减弱
C. 常温下,铁片不能与浓硝酸发生反应D. 植物油酸性条件下水解生成肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气与一氧化氮在常温常压条件下合成亚硝酰氯(NOCl)。已知亚硝酰氯是一种黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易反应生成一种无氧酸和两种氮的常见氧化物
(1)甲组同学拟制备原料气NO和Cl2制备装置如图所示

①为制备并得到纯净干燥的气体,补充下表中缺少的药品。
装置I中药品 | 装置II中药品 | ||
蒸馏烧瓶 | a仪器 | ||
制备纯净Cl2 | KmnO4 | 浓盐酸 | (i)___________ |
制备纯净的NO | Cu | (ii)__________ | 水 |
②仪器a的名称为____;装置Ⅲ的作用是______________。
(2)乙组同学对甲组同学制取NO的装置略加改良,利用甲组制得的Cl2共同制备NOCl,装置如下图所示

①组装好实验装置,检查气密性,依次装入药品。此实验关健操作有两点:I将Cl2充满D装置的三颈瓶;Ⅱ,A中反应开始时,先关闭K2,打开K1,待NO充满装置后关闭K1,打开K2。这两步操作都要“充满”,目的是__________。
②装置B中水的作用是___________________(用化学方程式表示)。
③若装置C中压强过大,可以观察到的现象是________________。
④装置D中冰盐水的作用是___________________________。
⑤如果去掉盛有浓硫酸的C、装有无水CaCl2的E两装置,对该实验的主要影响是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() CH=CH-CHO),杏仁含苯甲醛(
CH=CH-CHO),杏仁含苯甲醛(![]() CHO)。下列说法错误的是
CHO)。下列说法错误的是
A. 肉桂醛,苯甲醛都能发生加成反应、取代反应和聚合反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学物质及其变化的一种常用的科学方法,下列分类不正确的是( )
A.纯碱、烧碱均属碱类
B.甲烷、乙醇、葡萄糖均属于有机物
C.盐酸、硫酸、硝酸均属酸类
D.糖类、油脂、蛋白质均属于营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号

②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com