
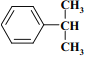
【题目】EPR橡胶(![]() )广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
)广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
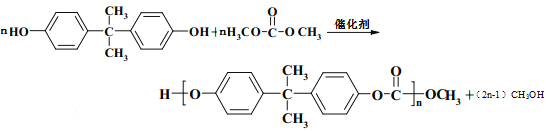
PC塑料( ![]() )的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
)的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:

已知:①RCOOR1 + R2OH ![]() RCOOR2 + R1OH
RCOOR2 + R1OH
②B、F、G、H、J各物质中,核磁共振氢谱都只有一组吸收峰。
(1)B的结构简式:_______________。
(2)A→D的反应类型:_______________。
(3)D→E的反应条件:_______________。
(4)E中官能团名称:_______________。
(5)E→F的化学方程式:_______________。
(6)H的结构简式:_______________。
(7)反应II的化学方程式:_______________。
(8)下列说法正确的是:_______________。
a、反应I的原子利用率为100%
b、1mol J与足量的NaOH溶液反应,消耗2molNaOH
c、CH3OH在合成PC塑料过程中可以循环利用
(9)反应I过程中,可以得到两种同类型副产物,且与M互为同分异构体,请写出其中一种结构:_______________。
(10)A ![]() N
N ![]() 苯酚+F,试推断N的结构:_______________
苯酚+F,试推断N的结构:_______________
【答案】CH2=CH2 加成反应 NaOH溶液,加热 羟基 2CH3CHOHCH3+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O 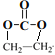
 b c
b c 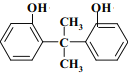 或
或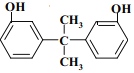
【解析】
由合成路线可知,A和B发生加聚反应生成EPR橡胶(![]() ),则A和B为乙烯、丙烯,由M的分子式并结合反应I可知,A、D、E、F均含有3个碳原子,故A为丙烯,则B为乙烯;A与溴化氢发生加成反应生成卤代烃D,卤代烃D发生水解生成醇E,醇E发生催化氧化生成F,由F和2分子苯酚反应生成M(C15H16O3)可推知F为丙酮,由此推出D为2-溴丙烷,E为2-丙醇;B为乙烯,乙烯发生催化氧化生成C,C和CO2反应生成H(C3H4O3),H和甲醇发生已知①的反应生成J和乙二醇,由反应II可推出J为
),则A和B为乙烯、丙烯,由M的分子式并结合反应I可知,A、D、E、F均含有3个碳原子,故A为丙烯,则B为乙烯;A与溴化氢发生加成反应生成卤代烃D,卤代烃D发生水解生成醇E,醇E发生催化氧化生成F,由F和2分子苯酚反应生成M(C15H16O3)可推知F为丙酮,由此推出D为2-溴丙烷,E为2-丙醇;B为乙烯,乙烯发生催化氧化生成C,C和CO2反应生成H(C3H4O3),H和甲醇发生已知①的反应生成J和乙二醇,由反应II可推出J为![]() ,结合已知①可推知H为
,结合已知①可推知H为 ,因此C应为环氧乙烷;苯酚与丙酮脱去1分子水生成M(
,因此C应为环氧乙烷;苯酚与丙酮脱去1分子水生成M(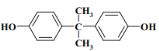 ),M发生信息中的取代反应得到聚碳酸酯PC。
),M发生信息中的取代反应得到聚碳酸酯PC。
由合成路线可知,A和B发生加聚反应生成EPR橡胶(![]() ),则A和B为乙烯、丙烯,由M的分子式并结合反应I可知,A、D、E、F均含有3个碳原子,故A为丙烯,则B为乙烯;A与溴化氢发生加成反应生成卤代烃D,卤代烃D发生水解生成醇E,醇E发生催化氧化生成F,由F和2分子苯酚反应生成M(C15H16O3)可推知F为丙酮,由此推出D为2-溴丙烷,E为2-丙醇;B为乙烯,乙烯发生催化氧化生成C,C和CO2反应生成H(C3H4O3),H和甲醇发生已知①的反应生成J和乙二醇,由反应II可推出J为
),则A和B为乙烯、丙烯,由M的分子式并结合反应I可知,A、D、E、F均含有3个碳原子,故A为丙烯,则B为乙烯;A与溴化氢发生加成反应生成卤代烃D,卤代烃D发生水解生成醇E,醇E发生催化氧化生成F,由F和2分子苯酚反应生成M(C15H16O3)可推知F为丙酮,由此推出D为2-溴丙烷,E为2-丙醇;B为乙烯,乙烯发生催化氧化生成C,C和CO2反应生成H(C3H4O3),H和甲醇发生已知①的反应生成J和乙二醇,由反应II可推出J为![]() ,结合已知①可推知H为
,结合已知①可推知H为 ,因此C应为环氧乙烷;苯酚与丙酮脱去1分子水生成M(
,因此C应为环氧乙烷;苯酚与丙酮脱去1分子水生成M( ),M发生信息中的取代反应得到聚碳酸酯PC。
),M发生信息中的取代反应得到聚碳酸酯PC。
(1)B为乙烯,结构简式为:CH2=CH2,
故答案为:CH2=CH2;
(2) A→D的反应为丙烯与溴化氢发生加成反应生成2-溴丙烷,反应类型为:取代反应,
故答案为:取代反应;
(3)D→E的反应为2-溴丙烷水解生成2-丙醇,故反应条件为:NaH溶液,加热,
故答案为:NaOH溶液,加热;
(4)E为2-丙醇,含有的官能团名称是羟基,
故答案为:羟基;
(5)E→F的反应为2-丙醇的催化氧化反应,化学方程式为:2CH3CHOHCH3+O2![]() 2CH3COCH3+2H2O,
2CH3COCH3+2H2O,
故答案为:2CH3CHOHCH3+O2![]() 2CH3COCH3+2H2O;
2CH3COCH3+2H2O;
(6)H的结构简式: ,
,
故答案为: ;
;
(7)反应II的化学方程式: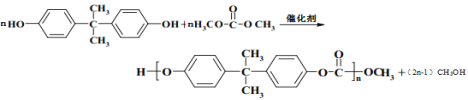 ,
,
故答案为: ;
;
(8) a、反应I为苯酚与丙酮脱去1分子水生成M( ),原子利用率不是100%,故a错误;
),原子利用率不是100%,故a错误;
b、J为![]() ,分子中含有两个酯基,所以1mol J与足量的NaOH溶液反应,消耗2molNaOH,故b正确;
,分子中含有两个酯基,所以1mol J与足量的NaOH溶液反应,消耗2molNaOH,故b正确;
c、由合成路线可知,H和甲醇反应生成J和乙二醇,J和M发生反应II又生成甲醇,所以CH3OH在合成PC塑料过程中可以循环利用,故c正确;
故答案为:bc;
(9)苯酚和丙酮发生反应I生成M( ),与M同类型且互为同分异构体的结构可能为:
),与M同类型且互为同分异构体的结构可能为: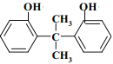 或
或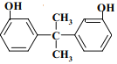 ;
;
故答案为: 或
或 ;
;
(10) A为CH2=CHCH3,苯和丙烯在催化剂存在条件下反应生成N,N先氧化后酸化生成苯酚和丙酮,由此可推断N的结构为: ,
,
故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 molL-1盐酸、0.55 molL-1NaOH溶液,实验尚缺少的玻璃用品是__、__。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?__(填“能”或“否”),其原因是__。
(3)他们记录的实验数据如下:
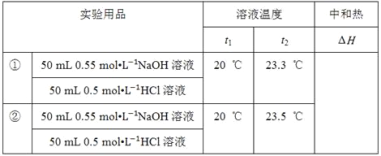
已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18 J℃﹣1g﹣1,各物质的密度均为1 gcm﹣3。
① 计算完成上表ΔH=__(保留2位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。
(4)若用KOH代替NaOH,对测定结果__(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果__(“有”或“无”)填影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下:

请回答下列问题:
(1)Sn(ⅣA)、As(VA)、Sb(VA)三种元素中,As和Sb最高正化合价为___________,Sn的原子序数为50,其原子结构示意图为___________。
(2)从溶液中得到锡酸钠晶体的实验操作是___________、趁热过滤、干燥。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是______________________;如图是“碱浸”实验的参数,请选择“碱浸”的合适条件_________________________________。

(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时发生的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
A.10Be和9Be是中子数不同质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2 g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数、中子数和核外电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号

②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 标准状况下,18g水的体积约为 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子数为3NA
C. NA个一氧化碳分子和 0.5mol 甲烷的质量比为 7∶4
D. 同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,50mL0.1mol/L醋酸中存在下述平衡:___________________________(用离子方程式表示)
若分别作如下改变,对上述平衡有何影响?
(1)加入少量冰醋酸,平衡将__________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变);
(2)加入一定量蒸馏水,平衡将__________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
(3)加入少量0.1mol/L盐酸,平衡将_________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
(4)加入20mL0.10mol/LNaCl,平衡将_________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com