
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщвЊЭъГЩжаКЭШШЕФВтЖЈЁЃ
(1)ЪЕбщзРЩЯБИгаДѓЁЂаЁСНИіЩеБЁЂХнФЫмСЯЁЂХнФЫмСЯАхЁЂНКЭЗЕЮЙмЁЂЛЗаЮВЃСЇНСАшАєЁЂ0.5 molL-1бЮЫсЁЂ0.55 molL-1NaOHШмвКЃЌЪЕбщЩаШБЩйЕФВЃСЇгУЦЗЪЧ__ЁЂ__ЁЃ
(2)ЪЕбщжаФмЗёгУЛЗаЮЭЫПНСАшАєДњЬцЛЗаЮВЃСЇНСАшАєЃП__ЃЈЬюЁАФмЁБЛђЁАЗёЁБЃЉЃЌЦфдвђЪЧ__ЁЃ
(3)ЫћУЧМЧТМЕФЪЕбщЪ§ОнШчЯТЃК
вбжЊЃКQ=cm(t2Љt1)ЃЌЗДгІКѓШмвКЕФБШШШШнcЮЊ4.18 JЁцЉ1gЉ1ЃЌИїЮяжЪЕФУмЖШОљЮЊ1 gcmЉ3ЁЃ
Ђй МЦЫуЭъГЩЩЯБэІЄH=__ЃЈБЃСє2ЮЛаЁЪ§ЃЉЁЃ
ЂкИљОнЪЕбщНсЙћаДГіNaOHШмвКгыHClШмвКЗДгІЕФШШЛЏбЇЗНГЬЪНЃК__ЁЃ
(4)ШєгУKOHДњЬцNaOHЃЌЖдВтЖЈНсЙћ__ЃЈЬюЁАгаЁБЛђЁАЮоЁБЃЉгАЯьЃЛШєгУДзЫсДњЬцHClзіЪЕбщЃЌЖдВтЖЈНсЙћ__ЃЈЁАгаЁБЛђЁАЮоЁБЃЉЬюгАЯьЁЃ
ЁОД№АИЁПЃЈ1ЃЉСПЭВЃЛЮТЖШМЦЃЛ
ЃЈ2ЃЉВЛФмЃЛН№ЪєвзЕМШШЃЌШШСПЩЂЪЇЕМжТЮѓВюДѓЃЛЃЈ3ЃЉЂйЉ56.85ЃЛ
ЂкHClЃЈaqЃЉ+NaOHЃЈaqЃЉ=NaClЃЈaqЃЉ+H2OЃЈlЃЉЁїH=Љ56.8kJmolЉ1ЃЛ
ЃЈ4ЃЉЮоЃЛгаЃЎ
ЁОНтЮіЁП
ЃЈ1ЃЉжаКЭШШЕФВтЖЈЙ§ГЬжаЃЌашвЊгУСПЭВСПШЁЫсШмвКЁЂМюШмвКЕФЬхЛ§ЃЌашвЊЪЙгУЮТЖШМЦВтСПЮТЖШЃЌЫљвдЛЙШБЩйЮТЖШМЦКЭСПЭВЃЛ
ЃЈ2ЃЉВЛФмгУЛЗаЮЭЫПНСАшАєДњЬцЛЗаЮВЃСЇНСАшАєЃЌвђЮЊЭЫПНСАшАєЪЧШШЕФСМЕМЬхЃЌШШСПЫ№ЪЇДѓЃЌ
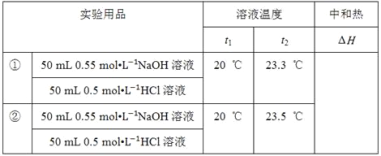
ЃЈ3ЃЉЂйЕк1ДЮЪЕбщЗДгІЧАКѓЮТЖШВюЮЊЃК3.3ЁцЃЌЕк2ДЮЪЕбщЗДгІЧАКѓЮТЖШВюЮЊЃК3.5ЁцЃЌЦНОљЮТЖШВюЮЊ3.4ЁцЃЌ50 mL0.55 molLЉ1NaOHШмвКгы50 mL0.5 molLЉ1HClШмвКЕФжЪСПКЭЮЊm=100mLЁС1g/cm3=100gЃЌc=4.18J/ЃЈgЁцЃЉЃЌДњШыЙЋЪНQ=cmЁїTЕУЩњГЩ0.05molЕФЫЎЗХГіШШСПQ=4.18J/ЃЈgЁцЃЉЁС100gЁС3.4Ёц=1421.2J=1.4212kJЃЌМДЩњГЩ0.025molЕФЫЎЗХГіШШСПЮЊЃК1.4212kJЃЌЫљвдЩњГЩ1molЕФЫЎЗХГіШШСПЮЊЃК![]() =56.85kJЃЌМДИУЪЕбщВтЕУЕФжаКЭШШЁїH=Љ56.85kJ/molЃЛ
=56.85kJЃЌМДИУЪЕбщВтЕУЕФжаКЭШШЁїH=Љ56.85kJ/molЃЛ
ЂкЯЁбЮЫсКЭNaOHЯЁШмвКЗДгІЩњГЩ1molЫЎЗХШШ56.8KJЃЌИУЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊЃКHClЃЈaqЃЉ+NaOHЃЈaqЃЉ=NaClЃЈaqЃЉ+H2OЃЈlЃЉЁїH=Љ56.8kJmolЉ1ЃЛ
ЃЈ4ЃЉKOHДњЬцNaOHЖМЪЧЧПМюЃЌЗћКЯжаКЭШШЕФИХФюЃЌЫљвдгУKOHДњЬцNaOHЃЌЖдВтЖЈНсЙћЮогАЯьЃЛДзЫсЮЊШѕЫсЃЌЕчРыЙ§ГЬЮЊЮќШШЙ§ГЬЃЌЫљвдгУДзЫсДњЬцHClзіЪЕбщЃЌЗДгІЗХГіЕФШШСПаЁгк56.8kJЃЌЕЋЁїHЦЋДѓЃЛ


 УћЪІЕМКНЕЅдЊЦкФЉГхДЬ100ЗжЯЕСаД№АИ
УћЪІЕМКНЕЅдЊЦкФЉГхДЬ100ЗжЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКуЮТЬѕМўЯТЃЌПЩФцЗДгІЃК2NOЃЈgЃЉ+O2ЃЈgЃЉ![]() 2NO2ЃЈgЃЉдкЬхЛ§ЙЬЖЈЕФУмБеШнЦїжаНјааЃЌДяЕНЦНКтзДЬЌЕФБъжОЕФЪЧЃЈЁЁЁЁЃЉ
2NO2ЃЈgЃЉдкЬхЛ§ЙЬЖЈЕФУмБеШнЦїжаНјааЃЌДяЕНЦНКтзДЬЌЕФБъжОЕФЪЧЃЈЁЁЁЁЃЉ
ЂйЕЅЮЛЪБМфФкЩњГЩn mol O2ЕФЭЌЪБЩњГЩ2n mol NO2ЂкЕЅЮЛЪБМфФкЩњГЩn mol O2ЕФЭЌЪБЩњГЩ2n mol NOЂлгУNO2ЁЂNOЁЂO2БэЪОЕФЗДгІЫйТЪЕФБШЮЊ2ЃК2ЃК1ЕФзДЬЌЂмЛьКЯЦјЬхЕФбеЩЋВЛдйИФБфЕФзДЬЌЂнЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЕФзДЬЌЂоЛьКЯЦјЬхЕФбЙЧПВЛдйИФБфЕФзДЬЌЂпЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБфЕФзДЬЌЃЎ
A. ЂйЂмЂоЂп B. ЂкЂлЂнЂп C. ЂйЂлЂмЂн D. ШЋВП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ГЃЮТГЃбЙЯТЃЌТШЦјЕФФІЖћжЪСПЕШгк71 g
B. 1 mol H2SO4жаКЌга2 molЧтдЊЫи
C. ФГЮяжЪЕФФІЖћжЪСПОЭЪЧИУЮяжЪЕФЯрЖдЗжзгжЪСПЛђЯрЖддзгжЪСП
D. 2 gКЄЦјЫљКЌЕФдзгЪ§ФПдМЮЊ0.5ЁС6.02ЁС1023
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЕФЖЈШнШнЦїжаЃЌЕБЯТСаФФаЉЮяРэСПВЛдйЗЂЩњБфЛЏЪБЃЌБэУїЗДгІA(g)ЃЋ2B(g)![]() C(g)ЃЋD(g)вбДяЕНЦНКтзДЬЌ
C(g)ЃЋD(g)вбДяЕНЦНКтзДЬЌ
ЂйЛьКЯЦјЬхЕФбЙЧПЁЁ ЂкЛьКЯЦјЬхЕФУмЖШЁЁ Ђл BЕФЮяжЪЕФСПХЈЖШЁЁ Ђм ЛьКЯЦјЬхЕФзмЮяжЪЕФСП ЂнЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПЁЁ Ђоv(C)гыv(D)ЕФБШжЕЁЁ ЂпЛьКЯЦјЬхЕФзмжЪСПЁЁЂрЛьКЯЦјЬхЕФзмЬхЛ§ ЁЁЂсCЁЂDЕФЗжзгЪ§жЎБШЮЊ1ЁУ1
A. ЂйЂкЂлЂмЂнЂоЂпЂр B. ЂйЂлЂмЂн C. ЂйЂкЂлЂмЂнЂп D. ЂйЂлЂмЂнЂрЂс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭъГЩЯТСаЬюПе
ЃЈ1ЃЉжЪСПжЎБШЮЊ16ЁУ7ЁУ6ЕФШ§жжЦјЬхSO2ЁЂCOЁЂNOЃЌЗжзгЪ§жЎБШЮЊ___ЃЛбѕдзгЪ§жЎБШЮЊ____ЃЛЯрЭЌЬѕМўЯТЕФЬхЛ§жЎБШЮЊ____ЁЃ
ЃЈ2ЃЉБъзМзДПіЯТЃЌ1.7gNH3гыБъзМзДПіЯТ___LH2SКЌгаЯрЭЌЪ§ФПЕФЧтдзгЁЃ
ЃЈ3ЃЉФГЦјЬхбѕЛЏЮяЕФЛЏбЇЪНЮЊRO2ЃЌБъзМзДПіЯТЃЌ1.28gИУбѕЛЏЮяЕФЬхЛ§ЮЊ448mLЃЌдђИУбѕЛЏЮяЕФФІЖћжЪСПЮЊ____ЃЌRЕФЯрЖддзгжЪСПЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП20ЁцЪБЃЌNaClШмНтгкЫЎЕФЪЕбщЪ§ОнШчЯТБэЫљЪО
ЪЕбщађКХ | ЫЎЕФжЪСП/g | МгШыЕФNaClжЪСП/g | ЮДШмЕФNaClжЪСП/g |
10 | 2 | 0 | |
10 | 3 | 0 | |
10 | 4 | 0.4 |
ЯТСаа№Ъіе§ШЗЕФЪЧ( )
A. ЪЕбщЂйЫљЕУЕФШмвКЮЊБЅКЭШмвК B. ЪЕбщЂкЫљЕУЕФШмвКЮЊБЅКЭШмвК
C. 20ЁцЪБNaClЕФШмНтЖШЮЊ30g D. ЪЕбщЂйЫљЕУШмвКЕФШмжЪжЪСПЗжЪ§ЮЊ16.7%
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПEPRЯ№НК(![]() )ЙуЗКгІгУгкЦћГЕВПМўЁЂНЈжўгУЗРЫЎВФСЯЁЂЕчЯпЕчРТЛЄЬзЁЂФЭШШНКЙмЁЂЦћГЕУмЗтМўЁЂШѓЛЌгЭЬэМгМСМАЦфЫќжЦЦЗЁЃ
)ЙуЗКгІгУгкЦћГЕВПМўЁЂНЈжўгУЗРЫЎВФСЯЁЂЕчЯпЕчРТЛЄЬзЁЂФЭШШНКЙмЁЂЦћГЕУмЗтМўЁЂШѓЛЌгЭЬэМгМСМАЦфЫќжЦЦЗЁЃ
PCЫмСЯ( ![]() )ЕФЭИЙтадСМКУЃЌПЩжЦзїГЕЁЂДЌЁЂЗЩЛњЕФЕВЗчВЃСЇвдМАблОЕЕШЁЃЫќУЧЕФКЯГЩТЗЯпШчЯТЃК
)ЕФЭИЙтадСМКУЃЌПЩжЦзїГЕЁЂДЌЁЂЗЩЛњЕФЕВЗчВЃСЇвдМАблОЕЕШЁЃЫќУЧЕФКЯГЩТЗЯпШчЯТЃК

вбжЊЃКЂйRCOOR1 + R2OH ![]() RCOOR2 + R1OH
RCOOR2 + R1OH
ЂкBЁЂFЁЂGЁЂHЁЂJИїЮяжЪжаЃЌКЫДХЙВеёЧтЦзЖМжЛгавЛзщЮќЪеЗхЁЃ
(1)BЕФНсЙЙМђЪНЃК_______________ЁЃ
(2)AЁњDЕФЗДгІРраЭЃК_______________ЁЃ
(3)DЁњEЕФЗДгІЬѕМўЃК_______________ЁЃ
(4)EжаЙйФмЭХУћГЦЃК_______________ЁЃ
(5)EЁњFЕФЛЏбЇЗНГЬЪНЃК_______________ЁЃ
(6)HЕФНсЙЙМђЪНЃК_______________ЁЃ
(7)ЗДгІIIЕФЛЏбЇЗНГЬЪНЃК_______________ЁЃ
(8)ЯТСаЫЕЗЈе§ШЗЕФЪЧЃК_______________ЁЃ
aЁЂЗДгІIЕФдзгРћгУТЪЮЊ100%
bЁЂ1mol JгызуСПЕФNaOHШмвКЗДгІЃЌЯћКФ2molNaOH
cЁЂCH3OHдкКЯГЩPCЫмСЯЙ§ГЬжаПЩвдбЛЗРћгУ
(9)ЗДгІIЙ§ГЬжаЃЌПЩвдЕУЕНСНжжЭЌРраЭИБВњЮяЃЌЧвгыMЛЅЮЊЭЌЗжвьЙЙЬхЃЌЧыаДГіЦфжавЛжжНсЙЙЃК_______________ЁЃ
(10)A ![]() N
N ![]() БНЗг+FЃЌЪдЭЦЖЯNЕФНсЙЙЃК_______________
БНЗг+FЃЌЪдЭЦЖЯNЕФНсЙЙЃК_______________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ25ЁцЪБCH3COOHЕФЕчРыГЃЪ§K=1.6ЁС10-5ЃЎИУЮТЖШЯТЯђ20ml 0.01molL-1 CH3COOHШмвКжаж№ЕЮМгШы0.01molL-1 KOHШмвКЃЌЦфpHБфЛЏЧњЯпШчЭМЫљЪОЃЈКіТдЮТЖШБфЛЏЃЉЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧ

A. aЕуШмвКжаcЃЈH+ЃЉЮЊ4.0ЁС10-5mol/L
B. cЕуШмвКжаЕФРызгХЈЖШДѓаЁЫГађЮЊcЃЈK+ЃЉ>cЃЈCH3COO-ЃЉ>cЃЈH+ЃЉ=cЃЈOH-ЃЉ
C. V=20
D. aЁЂbЁЂcШ§ЕужаЫЎЕФЕчРыГЬЖШзюДѓЕФЪЧcЕу
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП100ЁцЪБЃЌНЋ0.1 mol N2O4жУгк1 LУмБеЕФЩеЦПжаЃЌШЛКѓНЋЩеЦПЗХШы100ЁцЕФКуЮТВлжаЃЌЩеЦПФкЕФЦјЬхж№НЅБфЮЊКьзиЩЋЃКN2O4(g) ![]() 2NO2 (g)ЁЃЯТСаНсТлВЛФмЫЕУїЩЯЪіЗДгІдкИУЬѕМўЯТвбОДяЕНЗДгІЯоЖШЕФЪЧЃЈ ЃЉ
2NO2 (g)ЁЃЯТСаНсТлВЛФмЫЕУїЩЯЪіЗДгІдкИУЬѕМўЯТвбОДяЕНЗДгІЯоЖШЕФЪЧЃЈ ЃЉ
ЂйN2O4ЕФЯћКФЫйТЪгыNO2ЕФЩњГЩЫйТЪжЎБШЮЊ1ЁУ2ЃЛЂкNO2ЕФЩњГЩЫйТЪгыNO2ЯћКФЫйТЪЯрЕШЃЛЂлЩеЦПФкЦјЬхЕФбЙЧПВЛдйБфЛЏЃЛЂмЩеЦПФкЦјЬхЕФжЪСПВЛдйБфЛЏЃЛЂнNO2ЕФЮяжЪЕФСПХЈЖШВЛдйИФБфЃЛЂоЩеЦПФкЦјЬхЕФбеЩЋВЛдйМгЩюЃЛЂпЩеЦПФкЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйБфЛЏЃЛЂрЩеЦПФкЦјЬхЕФУмЖШВЛдйБфЛЏЁЃ
A. ЂкЂлЂоЂп B. ЂйЂмЂр
C. жЛгаЂйЂм D. жЛгаЂпЂр
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com