
【题目】已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01molL-1 CH3COOH溶液中逐滴加入0.01molL-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是

A. a点溶液中c(H+)为4.0×10-5mol/L
B. c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-)
C. V=20
D. a、b、c三点中水的电离程度最大的是c点
【答案】D
【解析】
根据平衡常数计算 c(H+);根据电荷守恒c点溶液中 c(K+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,说明c(H+)=c(OH-);若V=20,则醋酸与 KOH恰好完全反应,溶质为CH3COOK;a、b点溶液呈酸性,抑制了水的电离,c点溶液呈中性,基本不影响水的电离。
设a点溶液中c(H+)=xmol/L,则![]() ,x=4.0×10-4mol/L,故A错误;根据电荷守恒c点溶液中 c(K+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,说明c(H+)=c(OH-),所以c(K+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;若V=20,则醋酸与 KOH恰好完全反应,溶质为CH3COOK,此时溶液呈碱性,c点溶液呈中性,所以V<20,故C错误;根据图象可知,a、c溶液呈酸性,氢离子抑制了水的电离,水电离的c(H+)<1×10-7mol/L,而c点溶液的pH=7,呈中性,水电离的氢离子浓度为1×10-7mol/L,所以a、b、c三点中水的电离程度最大的是c点,故D正确。
,x=4.0×10-4mol/L,故A错误;根据电荷守恒c点溶液中 c(K+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,说明c(H+)=c(OH-),所以c(K+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;若V=20,则醋酸与 KOH恰好完全反应,溶质为CH3COOK,此时溶液呈碱性,c点溶液呈中性,所以V<20,故C错误;根据图象可知,a、c溶液呈酸性,氢离子抑制了水的电离,水电离的c(H+)<1×10-7mol/L,而c点溶液的pH=7,呈中性,水电离的氢离子浓度为1×10-7mol/L,所以a、b、c三点中水的电离程度最大的是c点,故D正确。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() CH=CH-CHO),杏仁含苯甲醛(
CH=CH-CHO),杏仁含苯甲醛(![]() CHO)。下列说法错误的是
CHO)。下列说法错误的是
A. 肉桂醛,苯甲醛都能发生加成反应、取代反应和聚合反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 molL-1盐酸、0.55 molL-1NaOH溶液,实验尚缺少的玻璃用品是__、__。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?__(填“能”或“否”),其原因是__。
(3)他们记录的实验数据如下:
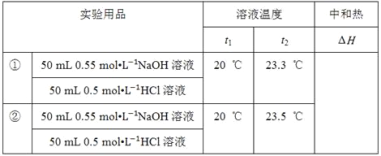
已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18 J℃﹣1g﹣1,各物质的密度均为1 gcm﹣3。
① 计算完成上表ΔH=__(保留2位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。
(4)若用KOH代替NaOH,对测定结果__(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果__(“有”或“无”)填影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
A.10Be和9Be是中子数不同质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2 g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数、中子数和核外电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号

②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:

(1)浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是_________________,植物粉的作用是_________________。
(2)除杂过程的操作为:
①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是____________________________;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式___________。
(3)在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在 6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____________;该反应的化学方程式为________;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________________________。
(4)已知:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,当离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 标准状况下,18g水的体积约为 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子数为3NA
C. NA个一氧化碳分子和 0.5mol 甲烷的质量比为 7∶4
D. 同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com