
【题目】25℃时,50mL0.1mol/L醋酸中存在下述平衡:___________________________(用离子方程式表示)
若分别作如下改变,对上述平衡有何影响?
(1)加入少量冰醋酸,平衡将__________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变);
(2)加入一定量蒸馏水,平衡将__________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
(3)加入少量0.1mol/L盐酸,平衡将_________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
(4)加入20mL0.10mol/LNaCl,平衡将_________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
【答案】CH3COOH![]() CH3COO-+ H+ 正向 增大 正向 减小 逆向 增大 正向 减小
CH3COO-+ H+ 正向 增大 正向 减小 逆向 增大 正向 减小
【解析】
醋酸为弱电解质,电离平衡方程式为:CH3COOH![]() CH3COO-+ H+。答案:CH3COOH
CH3COO-+ H+。答案:CH3COOH![]() CH3COO-+ H+。
CH3COO-+ H+。
(1)根据电离平衡方程式可知加入少量冰醋酸,平衡将正向移动,溶液中c(H+)将 增大。答案:正向 、 增大。
(2)加入一定量蒸馏水,平衡将正向,溶液中c(H+)将减小。答案: 正向、 减小。
(3)加入少量0.1mol/L盐酸,c(H+)增大,平衡将逆向移动,溶液中c(H+)将增大。答案:逆向 、 增大。
(4)加入20mL0.10mol/LNaCl,相当于加水稀释,平衡将正向移动,溶液中c(H+)将减小。答案:正向 、减小。


科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
)广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
PC塑料( ![]() )的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
)的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:

已知:①RCOOR1 + R2OH ![]() RCOOR2 + R1OH
RCOOR2 + R1OH
②B、F、G、H、J各物质中,核磁共振氢谱都只有一组吸收峰。
(1)B的结构简式:_______________。
(2)A→D的反应类型:_______________。
(3)D→E的反应条件:_______________。
(4)E中官能团名称:_______________。
(5)E→F的化学方程式:_______________。
(6)H的结构简式:_______________。
(7)反应II的化学方程式:_______________。
(8)下列说法正确的是:_______________。
a、反应I的原子利用率为100%
b、1mol J与足量的NaOH溶液反应,消耗2molNaOH
c、CH3OH在合成PC塑料过程中可以循环利用
(9)反应I过程中,可以得到两种同类型副产物,且与M互为同分异构体,请写出其中一种结构:_______________。
(10)A ![]() N
N ![]() 苯酚+F,试推断N的结构:_______________
苯酚+F,试推断N的结构:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜、铟、镓、硒等化合物。
(1)镓的基态原子的价电子排布式是___________。
(2)已知硒为第4周期ⅥA族元素,则硒与其相邻的同周期元素中,第一电离能从大到小顺序为___(用元素符号表示)。
(3)气态SeO3分子的立体构型为_____________________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为______;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为_______;
(7)一种铜金合金晶体具有面心立方最密堆积的结构.在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为______,若Au的原子半径为a pm,Cu的原子半径为b pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带 为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中), 得到海带灰悬浊液,然后按以下实验流程提取单质碘:
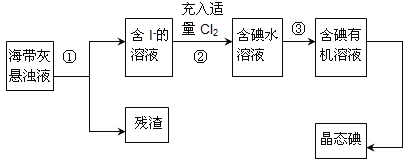
(1)指出提取碘的过程中有关的实验操作名称:①_______,③_______。
(2)操作③中所用的有机试剂可以是________(填序号)A.四氯化碳 B.乙醇,简述选择其理由________。
(3)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50mL碘水和15mL 有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收下层溶液;
H.从分液漏斗上口倒出上层液体;
①上述F步操作的目的是:____;
②最后碘的有机溶液是通过_____获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出其错误之处并加以改正_____。
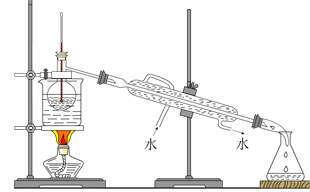
(5)进行上述蒸馏操作时,使用水浴的原因是 _______,最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列10种物质:①盐酸 ②石墨 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 溶液 ⑦酒精 ⑧NaHCO3 ⑨CO2 ⑩Na2CO310H2O。其中,属于非电解质有___,属于电解质的____。
(2)下列方程式中属于氧化还原反应的是___。
①2H2+O2![]() 2H2O ②CuO+H2
2H2O ②CuO+H2![]() Cu+H2O
Cu+H2O
③NH4HCO3![]() NH3↑+H2O↑+CO2↑ ④2CO+O2
NH3↑+H2O↑+CO2↑ ④2CO+O2![]() 2CO2
2CO2
⑤H2O(g)+C![]() H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
(3)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则A的相对原子质量=___。
(4)写出NaHCO3的电离方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100.0 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到16.84g沉淀,用过量稀硝酸处理后沉淀质量减少至6.99g,同时溶液中有气泡产生。试求:
(1)原混合液中Na2SO4的物质的量浓度为_____;
(2)产生的气体在标准状况下的体积为多少__________?(要求写出计算过程,只写结果不给分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com