
【题目】下列图中的实验,能达到实验目的的是( )
A.  证明稳定性:Na2CO3>NaHCO3
证明稳定性:Na2CO3>NaHCO3
B.  证明非金属性:Cl>Br>I
证明非金属性:Cl>Br>I
C.  验证镁和盐酸反应的热效应
验证镁和盐酸反应的热效应
D. 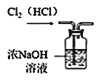 除去 Cl2 中的杂质气体 HCl
除去 Cl2 中的杂质气体 HCl
科目:高中化学 来源: 题型:
【题目】化学与环境保护、社会可持续发展密切相关,下列说法或做法合理的是
A. 进口国外电子垃圾,回收其中的贵重金属
B. 将地沟油回收加工为生物柴油,提高资源的利用率
C. 洗衣粉中添加三聚磷酸钠,增强去污效果
D. 大量生产超薄塑料袋,方便人们的日常生活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的叙述中错误的是
A. 在T℃时,某溶液中c(H+)=![]() ,则该溶液一定显中性
,则该溶液一定显中性
B. 25℃时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性
C. 常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多
D. 体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50mL0.55molL-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是 ______ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H= ______ (结果保留一位小数)。
(3) ______(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1) __________
__________
(2) ____________
____________
(3)![]() ___________
___________
(4)![]() ____________
____________
(5)2,6-二甲基-4-乙基辛烷_______
(6)2-甲基-1-戊烯____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A. 当混合气体平均相对分子质量为26时说明该反应已达平衡
B. 达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大
C. 根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D. 因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在高温下自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com