
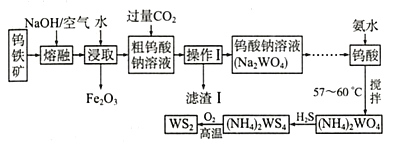
【题目】二硫化钨(WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备WS2的工艺流程如下图所示:
下列说法正确的是
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O
2Fe2O3+4Na2WO4+4H2O
C.已知(NH4)2WS4中W的化合价为+6,且2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,则生成124g WS2,该反应所转移的电子数目为2NA
2WS2+4NH3+2S+2SO2+2H2O,则生成124g WS2,该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
【答案】B
【解析】
由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,Al2O3和NaOH反应生成NaAlO2,水浸时,可除去不溶于水的氧化铁,向粗钨酸钠溶液中通入过量CO2,经过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Al(OH)3,滤液再经酸化得钨酸,向钨酸中加入氨水并控制温度得钨酸铵,继续通入H2S气体,生成(NH4)2WS4,最后将(NH4)2WS4在氧气中高温加热即可得到WS2;
A. 操作Ⅰ为过滤,需要的玻璃仪器有玻璃棒、漏斗、烧杯,故A错误;
B. FeWO4在碱熔过程中被空气中氧气氧化,生成Fe2O3、Na2WO4和H2O,发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O,故B正确;
2Fe2O3+4Na2WO4+4H2O,故B正确;
C. 已知(NH4)2WS4中W的化合价为+6,且2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,反应中(NH4)2WS4中+6价W被还原为+4价的WS2,-2价S元素被氧化成0价的S单质,每生成2molWS2转移了4mol电子,同时参加反应的氧气为3mol,则反应中共转移16mol电子,124gWS2的物质的量为:
2WS2+4NH3+2S+2SO2+2H2O,反应中(NH4)2WS4中+6价W被还原为+4价的WS2,-2价S元素被氧化成0价的S单质,每生成2molWS2转移了4mol电子,同时参加反应的氧气为3mol,则反应中共转移16mol电子,124gWS2的物质的量为:![]() =0.5mol,转移电子的物质的量为:16mol×
=0.5mol,转移电子的物质的量为:16mol×![]() =4mol,即转移电子数目为4NA,故C错误;
=4mol,即转移电子数目为4NA,故C错误;
D. 滤渣I的主要成分是氢氧化铝,过量盐酸可将氢氧化铝溶解,导致杂质铝除不干净,则CO2不可以用过量盐酸代替,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列有关有机物结构和性质的说法错误的是
A. 分子式为C5H10O2且能与 NaHCO3反应放出气体的结构共有4种
B. 石油是混合物,可通过分馏得到汽油、煤油等纯净物
C. 苯甲酸(![]() )分子中所有原子可能位于同一平面
)分子中所有原子可能位于同一平面
D. 1mol盐酸美西律( )最多可与3 mol H2发生加成
)最多可与3 mol H2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,充入1molN2和3molH2,并在一定温度和压强下,使其发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
(1)若保持容器容积不变,再向其中充入1molN2,反应速率会________(填“加快”“减慢”或“不变”,下同),理由是____________。
(2)若保持容器容积不变,再向其中充入1molHe,反应速率会________,理由是________。
(3)若保持容器内气体压强不变,再向其中充入1molHe,反应速率会________,理由是___________。
(4)加入催化剂,反应速率会________,理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
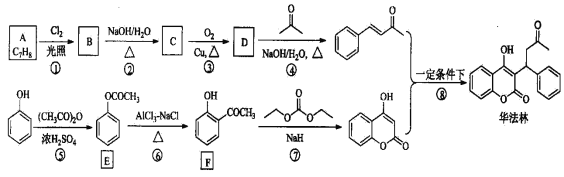
【题目】华法林(Warfarin)又名杀鼠灵,美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
请回答下列问题:
(1)A的名称为_____________________,E中官能团名称为____________________。
(2)B的结构简式为___________________________。
(3)由C生成D的化学方程式为________________________________________。
(4)⑤的反应类型为____________,⑧的反应类型为_______________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。a.能与FeCl3溶液发生显色反应; b.能发生银镜反应;其中核磁共振氢谱为五组峰的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
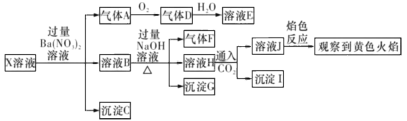
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)按每年全国发电燃煤8亿吨,煤中含硫质量分数以2%计,若不经过脱硫处理,则会有_______亿吨SO2排放到大气中(假设S全部转化为SO2)。
(2)下列物质中,能吸收SO2的有_______(填序号)。
a.氨水 b.酸性KMnO4溶液 c.生石灰 d.Na2CO3溶液
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收废气中的SO2并制备(NH4)2SO3·H2O,过程如下:
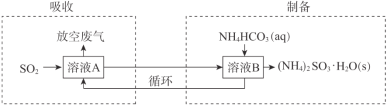
①“吸收”过程中,溶液中(NH4)2SO3和NH4HSO3物质的量之比变_____(填“大”或“小”)。
②“制备”过程中,溶液B中发生反应的化学方程式是 _____________________。
③检验产品(NH4)2SO3·H2O中含有少量SO42-的方法如下:取少量产品加水溶解,(将实验操作和现象补充完整)___________________________________。
(4)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) ΔH= -1627 kJmol-1
4N2(g)+6H2O(g) ΔH= -1627 kJmol-1
①被NO氧化的NH3和被O2氧化的NH3的物质的量之比为________________。
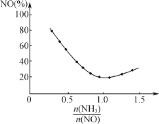
②氨氮比![]() 会直接影响该方法的脱硝率如图为350 ℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率如图为350 ℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是__________________。
>1.0时,烟气中NO含量反而增大,主要原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
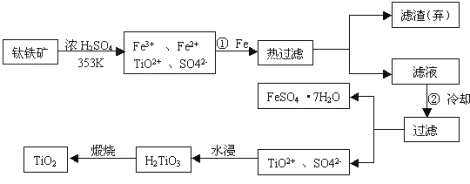
(1)Ti的原子序数为22,位于元素周期表中第_________周期第___________族。
(2)步骤①加铁的目的是___________________;步骤②冷却的目的是__________。
(3)写出流程中生成H2TiO3的离子方程式__________________________________。
(4)上述制备TiO2的过程中,考虑成本和废物综合利用因素,废液中应加入______处理。
(5)由金红石(TiO2 )制取单质Ti,涉及到的步骤为:TiO2→TiCl4![]() Ti
Ti
已知:① C(s) + O2 (g) = CO2 (g) ΔH = -393.5 kJmol-1
② 2CO(g) + O2 (g) = 2CO2(g) ΔH =-566 kJmol-1
③ TiO2 (s) + 2Cl2 (g) = TiCl4 (s) + O2 (g) ΔH = +141kJmol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) 的ΔH =___________。反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=______kJ·mol-1。
CH3OH(g) ΔH=______kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应速率的是________(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系
如右图所示。
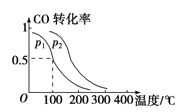
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________;
③在其他条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
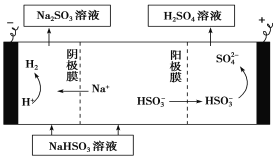
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:_____________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:
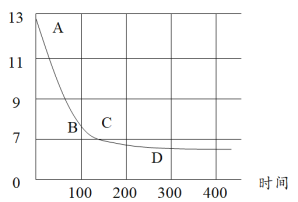
①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com