
【题目】设NA为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ΔH2 = bkJ mol-1
其他数据如下表所示,下列说法正确的是
化学键 | C=O | C—H | O—H | O=O |
键能/(kJ mol-1) | 798 | 413 | 463 | x |
A.ΔH1 < ΔH2
B.H2O(g) = H2O(1) ΔH=(a-b)kJ mol -1
C.当有4NA个O-H键生成时,反应放出的热量为a kJ
D.上文中x =![]()
【答案】A
【解析】
A.反应① ②都是甲烷燃烧,所有的燃烧都是放热反应,反应热ΔH<0,等量的甲烷完全燃烧生成液态水比生成气态水放出的热量多,则有a>b,因ΔH为负值,放出的热量越多,ΔH越小因,因此放出的ΔH1 < ΔH2,故A正确;
B. ①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1,②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g)ΔH2 = bkJ mol-1,根据盖斯定律![]() (①-②)可得:H2O(g) = H2O(1) ΔH=
(①-②)可得:H2O(g) = H2O(1) ΔH=![]() (a-b)kJ mol -1,故B错误;
(a-b)kJ mol -1,故B错误;
C. 当有4NA个O—H键生成时,反应消耗了1mol甲烷,按照反应①进行生成液态水放出的热量为a kJ,按照反应②进行生成液态水放出的热量为bkJ,故C错误;
D. 根据反应②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2=b kJ mol-1,ΔH2=413 kJ mol-1×4+2x kJ mol-1-(798 kJ mol-1×2+463 kJ mol-1×4)= bkJ mol-1,整理可得:x=![]() ,故D错误;
,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈的冶炼步骤为:用稀土串级萃取法对矿石进行筛选富集,电解熔融CeO2
B.CeO2溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2H2O
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce,它们互称为同位素
Ce,它们互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧1g乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ, 则这一反应的热化学反应方程式为( )
A. 2C2H2(g)+ 5O2(g) ═4CO2(g)+ 2H2O(l) ΔH= +50kJ/mol
B. C2H2(g)+ 5/2O2(g)═2CO2(g)+ H2O(l) ΔH= +1300kJ/mol
C. 2C2H2+ 5O2═4CO2+ 2H2O ΔH=-2600kJ
D. 2C2H2(g)+ 5O2(g)═4CO2(g)+ 2H2O(l) ΔH=-2600kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如下图所示,则比较下列大小关系:
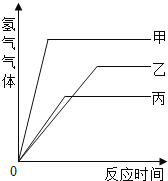
(1)三种金属的活动性由强到弱的顺序为:________________________。
(2)三种金属反应时消耗硫酸的质量由少到多的顺序为:_____________。
(3)三种金属的相对原子质量由大到小的顺序为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,充入1molN2和3molH2,并在一定温度和压强下,使其发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
(1)若保持容器容积不变,再向其中充入1molN2,反应速率会________(填“加快”“减慢”或“不变”,下同),理由是____________。
(2)若保持容器容积不变,再向其中充入1molHe,反应速率会________,理由是________。
(3)若保持容器内气体压强不变,再向其中充入1molHe,反应速率会________,理由是___________。
(4)加入催化剂,反应速率会________,理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,则下列有关说法中正确的是( )
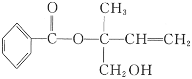
A. X的分子式为C12H16O3
B. 1 mol该有机物最多能与1 molNaOH反应
C. X在一定条件下能发生加成、加聚、取代、消去等反应
D. 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
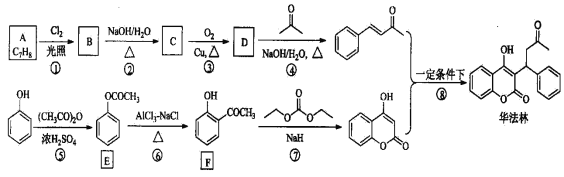
请回答下列问题:
(1)A的名称为_____________________,E中官能团名称为____________________。
(2)B的结构简式为___________________________。
(3)由C生成D的化学方程式为________________________________________。
(4)⑤的反应类型为____________,⑧的反应类型为_______________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。a.能与FeCl3溶液发生显色反应; b.能发生银镜反应;其中核磁共振氢谱为五组峰的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)按每年全国发电燃煤8亿吨,煤中含硫质量分数以2%计,若不经过脱硫处理,则会有_______亿吨SO2排放到大气中(假设S全部转化为SO2)。
(2)下列物质中,能吸收SO2的有_______(填序号)。
a.氨水 b.酸性KMnO4溶液 c.生石灰 d.Na2CO3溶液
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收废气中的SO2并制备(NH4)2SO3·H2O,过程如下:
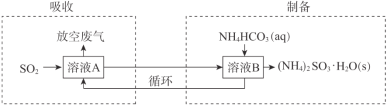
①“吸收”过程中,溶液中(NH4)2SO3和NH4HSO3物质的量之比变_____(填“大”或“小”)。
②“制备”过程中,溶液B中发生反应的化学方程式是 _____________________。
③检验产品(NH4)2SO3·H2O中含有少量SO42-的方法如下:取少量产品加水溶解,(将实验操作和现象补充完整)___________________________________。
(4)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) ΔH= -1627 kJmol-1
4N2(g)+6H2O(g) ΔH= -1627 kJmol-1
①被NO氧化的NH3和被O2氧化的NH3的物质的量之比为________________。
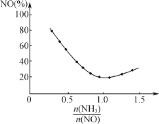
②氨氮比![]() 会直接影响该方法的脱硝率如图为350 ℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率如图为350 ℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是__________________。
>1.0时,烟气中NO含量反而增大,主要原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
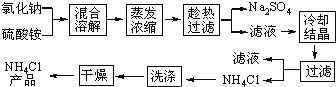
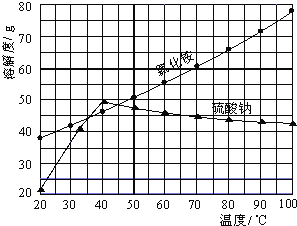
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl_________g。
(2)实验室进行蒸发浓缩用到的主要仪器有________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_________。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是_________________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com