
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如下图所示,则比较下列大小关系:
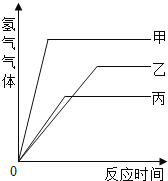
(1)三种金属的活动性由强到弱的顺序为:________________________。
(2)三种金属反应时消耗硫酸的质量由少到多的顺序为:_____________。
(3)三种金属的相对原子质量由大到小的顺序为:________________。
【答案】甲>丙>乙 丙<乙<甲 丙>乙>甲
【解析】
由产生氢气的体积与反应时间的关系图,等质量的甲最先完成反应而乙最后反应完成;完全反应后甲放出氢气量最大而丙最小,以此解答。
(1)等质量的甲、乙、丙三种金属,甲最先完成反应,其次为丙,而乙最后反应完全,因此可判断三种金属的活动性大小为甲>丙>乙;
(2)反应所放出氢气全部来自于稀硫酸,产生的氢气越多,消耗硫酸的质量越大,故三种金属反应时消耗硫酸的质量由少到多的顺序为:丙<乙<甲;
(3)根据一定量金属完全反应产生氢气质量=![]() ×金属的质量,因金属的质量及化合价均相同,所以金属的相对原子质量与反应放出氢气的多少成正比,则三种金属的相对原子质量是丙>乙>甲。
×金属的质量,因金属的质量及化合价均相同,所以金属的相对原子质量与反应放出氢气的多少成正比,则三种金属的相对原子质量是丙>乙>甲。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e的原子序数依次增大。a的简单阴离子与锂离子具有相同的电子层结构,b原子最外层电子数等于内层电子数的2倍。d的单质与稀盐酸剧烈反应放出a2。在1L0.2mol·L-1a2e的水溶液中缓慢通入ec2气体,该溶液的pH与ec2气体体积(标准状况)的关系如图所示。下列说法不正确的是
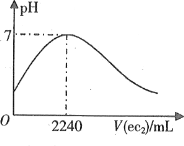
A.a和b可构成所有原子共平面的分子
B.在b、c、e的气态氢化物中,c的最稳定
C.d的氯化物一定能破坏水的电离平衡
D.e的最高价含氧酸与其氢化物可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A. 此反应是氧化还原反应
B. 反应瞬间产生大量高温气体,推动火箭飞行
C. 在此反应中![]() 作还原剂
作还原剂
D. R的分子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将总物质的量为amol的钠和铝的混合物投入到水中,若两者的物质的量之比n(Na):n(Al)=2:3,则生成的氢气在标准状况下的体积为( )
A.11.24a LB.36.6a LC.17.92a LD.44.82a L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 gcm﹣3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 molL﹣1的硫酸。
(1)需要量取该浓硫酸的体积为_______mL。
(2)实验需要以下步骤:
①定容 ②量取 ③摇匀 ④洗涤 ⑤转移 ⑥冷却 ⑦计算 ⑧装瓶 ⑨稀释
进行顺序为_______。
(3)下列操作使所配溶液的物质的量浓度偏高的是________。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
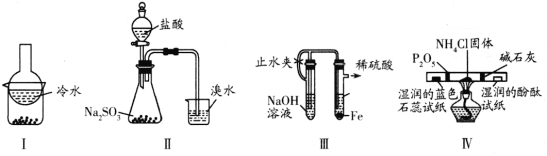
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ΔH2 = bkJ mol-1
其他数据如下表所示,下列说法正确的是
化学键 | C=O | C—H | O—H | O=O |
键能/(kJ mol-1) | 798 | 413 | 463 | x |
A.ΔH1 < ΔH2
B.H2O(g) = H2O(1) ΔH=(a-b)kJ mol -1
C.当有4NA个O-H键生成时,反应放出的热量为a kJ
D.上文中x =![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,采用以下路线合成X。
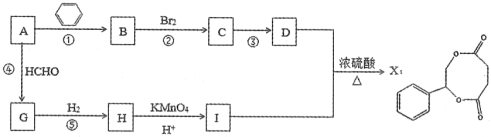
已知:RC≡CH+HCHO![]() RC≡CCH2OH
RC≡CCH2OH
请回答下列问题:
(1)若反应①、②、④的原子利用率均为100%,则A的名称为:_____。
(2)物质G的结构简式为:_____。
(3)写出反应③的化学反应方程式:______。
(4)物质E是物质D发生催化氧化后生成的有机产物,请写出E与银氨溶液反应的化学方程式:______。
(5)物质H和物质I可以在一定条件下合成链状聚合物,请写出化学方程式: ____。
(6)符合下列条件的D的同分异构体共有________种。
i.与FeCl3溶液能发生显色反应 ii.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有下列9种物质:①氧气;②二氧化硫;③稀硫酸;④铜;⑤氯化钡固体;⑥氢氧化钾固体;⑦硝酸钾溶液;⑧酒精(C2H5OH);⑨氧化钙固体,请将上述物质按要求完成下列问题(用相应化学式填空):
(1)属于酸性氧化物的有___________,属于电解质的是_______________________。
II.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(2)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是___________。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(3)写出制备Fe(OH)3胶体的化学方程式:__________________________。
(4)氢氧化铁胶体稳定存在的主要原因是______________(选填序号)。
A.胶体微粒直径小于1nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com