
����Ŀ�����Ȼ��ƺ������Ϊԭ���Ʊ��Ȼ�識�����Ʒ������,������������:
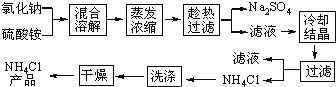
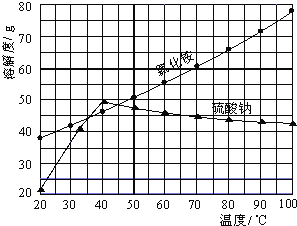
�Ȼ�狀������Ƶ��ܽ�����¶ȱ仯����ͼ��ʾ���ش��������⣺
��1�����Ʊ�10.7gNH4Cl����������NaCl_________g��
��2��ʵ���ҽ�������Ũ���õ�����Ҫ������________���ձ������������ƾ��Ƶȡ�
��3������ȴ�ᾧ�������У�����NH4Cl����ĺ����¶�Ϊ_________��
��4�����������Լ������NH4Cl��Ʒ�Ƿ��ķ�����������_________________��
��5����NH4Cl��Ʒ�к������������ʣ���һ���ᴿ��Ʒ�ķ�����________________��
���𰸡�11.7 ������ 35�棨33��40����ɣ� ���ȷ� ȡ�����Ȼ�鱗�Ʒ���Թܵײ������ȣ����Թܵײ�����������Ȼ�鱗�Ʒ���� ������Ʒ,���ռ��Թܿڲ���
��������
(1)����ClԪ���غ����NaCl��������
(2)����Һ����������
(3)���ܽ�������ж������ƺ��Ȼ�淋��ܽ�ȱ仯�ص����,��35��40��ʱ,�Ȼ�淋��ܽ��С�������Ƶ��ܽ�ȣ�
(4)�����Ȼ������ʱ�ֽ������˰������Ȼ�������,���ü��ȷ����NH4Cl��Ʒ�Ƿ���
(5)�����Ȼ�識����ֽ�,�����Ƽ������Էֽ������
(1) 10.7gNH4Cl�������ʵ���Ϊ10.7g/53.5g/mol=0.2mol,����ClԪ���غ�,��ҪNaCl�����ʵ���ҲΪ0.2mol,����Ϊ0.2mol��58.5g/mol=11.7g��
����:11.7��
(2)ʵ���ҽ�������Ũ���õ�����Ҫ������ �������ձ������������ƾ��Ƶȣ�
����:������
(3)���������Ƶ��ܽ�����߲��ѿ���,�ڵ���40��ʱ,�����Ƶ��ܽ�����¶ȵ����߶�����,����40��ʱ�����Ƶ��ܽ�����¶ȵ����߶���С;�������ʵ��ܽ�����߲��ѿ���,ֻ����35��~40��ʱ,�Ȼ�淋��ܽ��С�������Ƶ��ܽ�ȣ�
����: 35�棨33��40����ɣ���
(4)�����Ȼ������ʱ�ֽ������˰������Ȼ�������,���ü��ȷ����NH4Cl��Ʒ�Ƿ�,������:ȡ�����Ȼ�鱗�Ʒ���Թܵײ�,����,���Թܵײ�������,�����Ȼ�鱗�Ʒ������
����:���ȷ���ȡ�����Ȼ�鱗�Ʒ���Թܵײ������ȣ����Թܵײ�����������Ȼ�鱗�Ʒ������
(5)�Ȼ�識����ֽ�,�����Ƽ������Էֽ�,����Ʒ����,�ռ��Թܿ�����,�ɽ����߷��룻
����:������Ʒ,���ռ��Թܿڲ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ����֪��Ӧ��
��CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ��H1 = a kJ mol-1
��CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ��H2 = bkJ mol-1
�����������±���ʾ������˵����ȷ����
��ѧ�� | C=O | C��H | O��H | O=O |
����/(kJ mol-1) | 798 | 413 | 463 | x |
A.��H1 < ��H2
B.H2O(g) = H2O(1) ��H=(a-b)kJ mol -1
C.����4NA��O-H������ʱ����Ӧ�ų�������Ϊa kJ
D.������x =![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ʢ�м�С��þƬ���Թܷ���ʢ��25���ı���ʯ��ˮ���ձ��У����õι����Թ��е���2 mL��ϡ���ᡣ���ж��ձ��е�ʵ�������������ԭ��˵����ȷ����( )
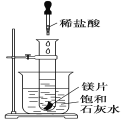
A. �ձ��г��ְ�ɫ���ǣ�ԭ�����Թ��еķ�Ӧ�ų�����ʹ�ձ��б���ʯ��ˮ�¶����ߣ���������
B. �ձ��г��ְ�ɫ���ǣ�ԭ�����Թ��еķ�Ӧ��������ʹ�ձ��б���ʯ��ˮ�¶Ƚ��ͣ���������
C. �ձ���û���κ�����ԭ�����Թ��еķ�Ӧ���ձ��б���ʯ��ˮ��������κ�Ӱ��
D. �ձ���û���κ�����ԭ�����Թ��еķ�Ӧ�Ȳ��ų�������Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��������9�����ʣ����������ڶ�������ϡ�����ͭ�����Ȼ������壻���������ع��壻���������Һ����ƾ�(C2H5OH)���������ƹ��壬�뽫�������ʰ�Ҫ�������������(����Ӧ��ѧʽ���)��
��1�������������������___________�����ڵ���ʵ���_______________________��
II.ij����С�����Fe(OH)3������Ʊ�ʵ�鲢������������ʡ�
��2����������FeCl3��Һ�ֱ��������Һ���У����γɽ������___________��
A.��ˮ B.��ˮ C.NaOHŨ��Һ D.NaClŨ��Һ
��3��д���Ʊ�Fe(OH)3����Ļ�ѧ����ʽ��__________________________��
��4���������������ȶ����ڵ���Ҫԭ����______________(ѡ�����)��
A.������ֱ��С��1nm B.�������������
C.�������������˶� D.������������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����ұ��п�����е�п������ZnO��FeO��Fe2O3��CuO��Al2O3�����ʣ�������������Zn(NO3)2��6H2O���壬�乤������Ϊ��
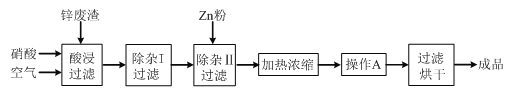
�й��������↑ʼ�����ͳ�����ȫ��pH���±���
�������� | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
��ʼ������pH | 3��3 | 1��5 | 6��5 | 4��2 | 5��4 |
������ȫ��pH | 5��2 | 3��7 | 9��7 | 6��7 | 8��0 |
���ڡ�����������У�Ϊ���п�Ľ������ʣ���ͨ����������衱�⣬���ɲ�ȡ�Ĵ�ʩ��_____________________��
���������������жദ�漰�����ˡ���ʵ�����й��˲�����Ҫʹ�õIJ���������_____��
���ڡ�����I�������У����ټ�������H2O2��Һ��H2O2��Fe2+��Ӧ�����ӷ���ʽΪ_____��ΪʹFe(OH)3��Al(OH)3������ȫ����Zn(OH)2��������Ӧ������Һ��pH��ΧΪ_____������Fe3+�Ƿ������ȫ��ʵ�������_____��
�ȼ���Zn�۵�������_____��������A����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������������Ͷ����������γ�����ʱ������еİ��йأ�����ͼ��ʾ�������������������

A. �������ķ�ɢ����ͬ
B. �����к�������狀������
C. NH3���γ���������Ĵ���
D. �������γ������ʩ�õ����й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4-CO2�������������Եõ��ϳ�����CO��H2����������������ļ��ž�����Ҫ���塣�ش��������⣺
��1��CH4-CO2��������ӦΪ��CH4(g)+CO2(g)=2CO(g)+2H2(g)��
��֪��C(s)+2H2(g)=CH4(g) ��H=-75 kJ��mol1
C(s)+O2(g)=CO2(g) ��H=-394 kJ��mol1
C(s)+1/2O2(g)=CO(g) ��H=-111 kJ��mol1
�ô�������Ӧ����H==______ kJ��mol1�����������CH4ƽ��ת���ʵ�������____�����ţ���
A�����µ�ѹ B�����¸�ѹ C�����¸�ѹ D�����µ�ѹ
ij�¶��£������Ϊ2 L�������м���2 mol CH4��1 mol CO2�Լ���������������Ӧ���ﵽƽ��ʱCO2��ת������50%����ƽ�ⳣ��Ϊ_______mol2��L2��
��2����Ӧ�д������Ի����̼��Ӧ�����ͣ�ͬʱ���ڵ���̼��Ӧ��ʹ��̼�����١�
����������±���
��̼��Ӧ CH4(g)=C(s)+2H2(g) | ��̼��Ӧ CO2(g)+C(s)=2CO(g) | ||
��H/(kJ��mol1) | 75 | 172 | |
���/ (kJ��mol1) | ����X | 33 | 91 |
����Y | 43 | 72 | |
�����ϱ��жϣ�����X____Y��������������������������������_________________���ڷ�Ӧ��������ɡ�ѹǿ����Ӧʱ����ͬ������£�ij��������Ļ�̼�����¶ȵı仯��ϵ��ͼ��ʾ�������¶�ʱ�����й��ڻ�̼��Ӧ����̼��Ӧ��ƽ�ⳣ����K�������ʣ�v����������ȷ����________���ţ���

A��K����K�������� B��v������v������
C��K����С��K������ D��v�����ӵı�����v�����ӵı�����
����һ���¶��£����ij�����ϳ���̼���������ʷ���Ϊv=k��p(CH4)��[p(CO2)]-0.5��kΪ���ʳ���������p(CH4)һ��ʱ����ͬp(CO2)�»�̼����ʱ��ı仯������ͼ��ʾ����pa(CO2)��pb(CO2)��pc(CO2)�Ӵ�С��˳��Ϊ________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ����ͼ��ʾ�������л�ѧ��Ӧ����ͼ����Ӱ���ֵ��ǣ� ��
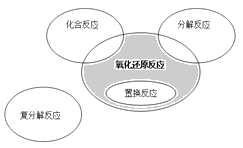
A.4Fe(OH)2+O2+2H2O== Fe(OH)3
B.2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
C.4NH3+5O2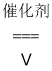 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4=ZnSO4+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Al�ֱ����0.3 L 1 mol��L-1�������NaOH��Һ��,���������������Ϊ1��2,�����Al������Ϊ(����)
A.2.7 gB.5.4 gC.8.1 gD.10 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com