
【题目】等量的Al分别加入0.3 L 1 mol·L-1的盐酸和NaOH溶液中,生成氢气的体积比为1∶2,则加入Al的质量为( )
A.2.7 gB.5.4 gC.8.1 gD.10 g
【答案】B
【解析】
由6HCl+2Al=2AlCl3+3H2↑和2NaOH+2Al+2H2O=2NaAlO2+3H2↑可知,两份等质量的Al都完全反应时,生成的H2也等量,若HCl与NaOH都完全反应,生成H2的体积比应为1∶3,实际上HCl、NaOH都为0.3 mol,且生成H2的体积比为1∶2,则盐酸与铝反应时,HCl不足、Al过量; 氢氧化钠与铝反应时,NaOH过量、Al不足。
设盐酸与铝反应生成氢气的物质的量是xmol;
6HCl+2Al=2AlCl3+3H2↑
6 3
0.3 mol xmol
![]()
x=0.15mol;
则氢氧化钠与铝反应生成氢气的物质的量是0.3mol,设参加反应的铝的物质的量是ymol,
2NaOH+2Al+2H2O=2NaAlO2+3H2↑
2 3
ymol 0.3mol
![]()
y=0.2mol
铝的质量是0.2mol×27g/mol=5.4g;
故选B。


科目:高中化学 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
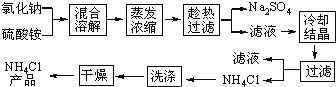
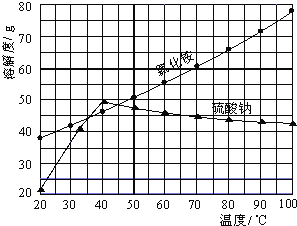
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl_________g。
(2)实验室进行蒸发浓缩用到的主要仪器有________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_________。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是_________________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
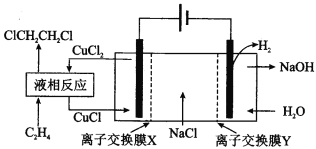
A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
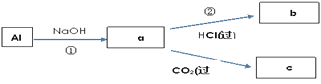
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
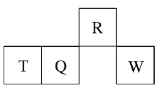
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 单质T与NaOH溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择。
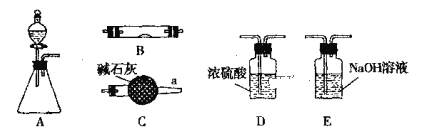
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、____________。
②检查好装置的气密性后加热B前必须进行的操作是_________________ 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
①各仪器装置按气流方向从左到右连接顺序A→C→B→C,请写出B中氨的催化氧化反应方程式____________________________ 。
②装置B中可能观察到的现象是_____________________________。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,装置的连接顺序为:A→D→B→E,根据实验现象回答问题:
①若将带余烬的木条靠近E的导管口,木条复燃,SO2表现酸性氧化物的性质,则反应的方程式可能为:____________________;
②若在E的导管口未收集到任何气体,SO2只表现还原性,则反应的方程式可能为:____________________。
③装置B中观察到的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:


下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
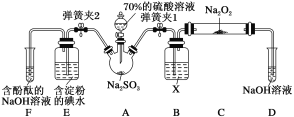
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸溶液至浸没三颈烧瓶中的固体。若将带火星的木条放在D试管口处,木条不复燃,说明SO2与Na2O2反应无O2生成,可能发生的化学方程式为____。
(2)关闭弹簧夹1,打开弹簧夹2,残余气体进入E、F中。E中的现象为___,E中反应的离子方程式为___。F中的现象为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com