
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:


下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。使Ba(OH)2·8H2O与NH4Cl充分反应。实验中观察到的现象是______________________,说明该反应是___________热反应,这是由于反应物所具有的总能量_________ (填“大于”、“小于”或“等于”生成物所具有的总能量。
(2)将Fe+2FeCl3=3FeCl2设计为一个原电池,则该电池的负极材料为__________,正极电极反应式为__________________________________。
(3)恒温下,将amo1N2与bmolH2的混合气体通入一容积固定的密闭容器中,发生如下反应:N2(g)+ 3H2(g)![]() 2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。现代工业上可通过煤化工的产物CO和H2来合成二甲醚,其主要反应为:
(ⅰ)CO(g)+2H2(g)![]() CH3OH(g) △H= -90.1kJ·mol-1
CH3OH(g) △H= -90.1kJ·mol-1
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H= -24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H= -24.5kJ·mol-1
(1)写出CO和H2来直接合成二甲醚的热化学方程式________。
(2)温度T时,在容积为2.00L的某密闭容器中进行上述反应(ⅰ),反应过程中相关数据如图1所示。
①下列说法能表明反应已达到平衡状态的是______。
a.容器中气体的压强不再变化 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不再变化 d.2υ正(H2)=υ逆(CH3OH)
②该化学反应0~10min的平均速率υ(H2)=_____。
③其他条件不变时,15mim时再向容器中加入等物质的量的CO和H2,则H2的转化率____(填增大、不变或减小)。

④对应气相反应,常用某组分(B)的平衡压强(pB)代替某物质的量浓度(cB)表示平衡常数(以Kp表示),其中,pB=p总×B的体积分数;若在T时平衡气体总压强为p总,则该反应Kp=_____。
⑤图2表示氢气转化率随温度变化的趋势,请解释T0后氢气转化率的变化原因__________。

(3)二甲醚燃料电池的工作原理如图所示,则X电极的电极反应式为__________。用该电池对铁制品镀铜,当铁制品质量增加12.8g时,理论上消耗二甲醚的质量为_________g。(精确到0.01)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。

回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
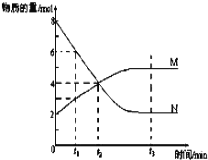
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
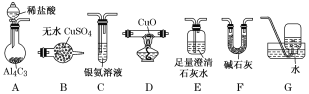
[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___;C、N、O的电负性由大到小的顺序为______。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______;配合物[Cu(NH3)2]OOCCH3中,铜显___价,碳原子的杂化轨道类型是______,NH3价电子对互斥理论模型是______。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________(填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________(写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___。
(2)在第③步操作中,选择的除杂剂NaOH不能用KOH代替,理由是___。
(3)第④步中加入过量的Na2CO3的目的是___。
(4)在第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、___(填化学式)。
(5)写出第⑥步操作反应的离子方程式:___、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com