
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
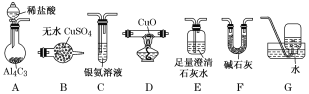
[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
【答案】Al4C3+12HCl===3CH4↑+4AlCl3F→D→B→E→C→G先打开分液漏斗上口的玻璃塞(或先使分液漏斗上口的玻璃塞的凹槽对准漏斗上的小孔),再将分液漏斗下面的旋塞打开,使稀盐酸缓慢滴下试管内有黑色固体生成(或试管内有银镜生成)除去甲烷中的HCl气体和水蒸气取少量红色固体,加入适量稀硫酸,若溶液变为蓝色,则证明红色固体中含有Cu2O取少量Cu2O固体于试管中,加入适量0.1mol·L1AgNO3溶液
【解析】
(1)A中Al4C3与盐酸发生复分解反应,反应方程式Al4C3+12HCl===3CH4↑+4AlCl3;因此本题答案是:Al4C3+12HCl===3CH4↑+4AlCl3。
(2)A中反应后,需除去气体可能携带的HCl,故紧接着是F,然后将气体通入反应器D,随后通入B中,检验是否有水生成,再通入澄清石灰水E,检验二氧化碳,最后通入C中检验一氧化碳,最后G收集尾气,故顺序为: F→D→B→E→C→G;综上所述,本题答案是:F→D→B→E→C→G。
(3)滴加稀盐酸操作:先打开分液漏斗上口的玻璃塞(或先将分液漏斗上口的玻璃塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的旋塞打开,使稀盐酸缓慢滴下;综上所述,本题答案是:先打开分液漏斗上口的玻璃塞(或先使分液漏斗上口的玻璃塞的凹槽对准漏斗上的小孔),再将分液漏斗下面的旋塞打开,使稀盐酸缓慢滴下。
(4)根据题给信息可知,气体产物中含有CO,所以C中银氨溶液可被还原为银,试管内有黑色固体生成;反应产生的甲烷气体中含有HCl和H2O,为了不影响后续反应,利用F装置除去甲烷中的HCl和H2O;综上所述,本题答案是:试管内有黑色固体生成(或试管内有银镜生成,除去甲烷中的HCl气体和水蒸气。
(5)欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu;乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验:
①取少量红色固体,加入适量稀硫酸,若溶液变蓝色,说明溶液中含有Cu2+,则证明红色固体中含Cu2O;综上所述,本题答案是:取少量红色固体,加入适量稀硫酸,若溶液变为蓝色,则证明红色固体中含有Cu2O。
②取少量的Cu2O固体于试管中,加入适量的0.1mol·L1AgNO3溶液,若溶液不变蓝,则可排除红色固体中Cu2O的干扰,证明其中含有Cu;综上所述,本题答案是:取少量Cu2O固体于试管中,加入适量0.1mol·L1AgNO3溶液。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() →Mn2++NO3-+H2O。下列叙述中正确的是( )
→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.![]() 中的粒子是OH-B.该反应中NO2-被还原
中的粒子是OH-B.该反应中NO2-被还原
C.反应过程中溶液的酸性增强D.生成1molNaNO3需消耗0.4molKMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是
A. 反应物具有的总能量大于生成物具有的总能量
B. 正反应为吸热反应
C. 该反应的逆反应是吸热过程
D. 图中可以看出,HBr的能量一定高于H2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:


下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是________。(填化学式)
(2)工艺师常用氢氟酸来雕刻玻璃,发生反应的化学方程式为_________。
(3)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,用氧化物形式表示为________。
(4)高纯度单晶硅可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
写出步骤①的化学方程式: _______。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃),提纯SiHCl3主要操作的名称是________。
步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外,还可能使产品中混有杂质________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl ![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。

(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是

A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列说法正确的是
A. 18 gT2O中含有的中子数为12NA
B. 用23.5gAgI与水制成的胶体中胶体粒子数目为0.1NA
C. 标准状况下,2.24LCl2全部溶于水所得溶液中的Cl-数目为0.1NA
D. 1mol某烷烃CnH2n+2(n≥1)分子中含有的共价键数为(3n+1)NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数) ( )
A. 124 g P4中含有P—P键的个数为4NA
B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA
D. 60 g SiO2中含有Si—O键的个数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com