
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() →Mn2++NO3-+H2O。下列叙述中正确的是( )
→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.![]() 中的粒子是OH-B.该反应中NO2-被还原
中的粒子是OH-B.该反应中NO2-被还原
C.反应过程中溶液的酸性增强D.生成1molNaNO3需消耗0.4molKMnO4
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于试剂存放的叙述正确的是( )
A.硝酸银溶液存放在无色试剂瓶中
B.金属钠保存在CCl4中(钠的密度小于CCl4)
C.氢氧化钠溶液保存在带玻璃塞的玻璃瓶中
D.浓硫酸的装运包装箱应贴上如图所示的标识

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。使Ba(OH)2·8H2O与NH4Cl充分反应。实验中观察到的现象是______________________,说明该反应是___________热反应,这是由于反应物所具有的总能量_________ (填“大于”、“小于”或“等于”生成物所具有的总能量。
(2)将Fe+2FeCl3=3FeCl2设计为一个原电池,则该电池的负极材料为__________,正极电极反应式为__________________________________。
(3)恒温下,将amo1N2与bmolH2的混合气体通入一容积固定的密闭容器中,发生如下反应:N2(g)+ 3H2(g)![]() 2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液M中存在的离子有Na+、A2、HA、H+、OH,存在的分子有 H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:_____________________________________;
(2)若溶液M是由10 mL 2 mol/L NaHA溶液与2 mol/L NaOH溶液等体积混合而得到 的,则溶液M的pH__________7(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为_____________________________。已知Ksp(BaA)= 1.8×1010,向该混合溶液中加入10 mL 1 mol/L BaCl2溶液,混合后溶液中Ba2+ 浓度为________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:

(1)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极的电极反应式为__________。当反应中收集到标准状况下224 mL气体时,消耗的电极质量为________g。
(2)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入甲烷燃料,采用氢氧化钠溶液为电解液,则电子从____极流出,a极的电极反应式为________。
(3)质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为24 g,则导线中通过的电子的物质的量_______mol。
(4)学法题:总结原电池负极的判断方法___________(至少2条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。现代工业上可通过煤化工的产物CO和H2来合成二甲醚,其主要反应为:
(ⅰ)CO(g)+2H2(g)![]() CH3OH(g) △H= -90.1kJ·mol-1
CH3OH(g) △H= -90.1kJ·mol-1
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H= -24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H= -24.5kJ·mol-1
(1)写出CO和H2来直接合成二甲醚的热化学方程式________。
(2)温度T时,在容积为2.00L的某密闭容器中进行上述反应(ⅰ),反应过程中相关数据如图1所示。
①下列说法能表明反应已达到平衡状态的是______。
a.容器中气体的压强不再变化 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不再变化 d.2υ正(H2)=υ逆(CH3OH)
②该化学反应0~10min的平均速率υ(H2)=_____。
③其他条件不变时,15mim时再向容器中加入等物质的量的CO和H2,则H2的转化率____(填增大、不变或减小)。

④对应气相反应,常用某组分(B)的平衡压强(pB)代替某物质的量浓度(cB)表示平衡常数(以Kp表示),其中,pB=p总×B的体积分数;若在T时平衡气体总压强为p总,则该反应Kp=_____。
⑤图2表示氢气转化率随温度变化的趋势,请解释T0后氢气转化率的变化原因__________。

(3)二甲醚燃料电池的工作原理如图所示,则X电极的电极反应式为__________。用该电池对铁制品镀铜,当铁制品质量增加12.8g时,理论上消耗二甲醚的质量为_________g。(精确到0.01)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
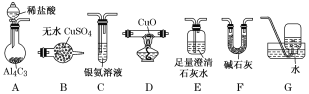
[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com