
【题目】常温下,某溶液M中存在的离子有Na+、A2、HA、H+、OH,存在的分子有 H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:_____________________________________;
(2)若溶液M是由10 mL 2 mol/L NaHA溶液与2 mol/L NaOH溶液等体积混合而得到 的,则溶液M的pH__________7(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为_____________________________。已知Ksp(BaA)= 1.8×1010,向该混合溶液中加入10 mL 1 mol/L BaCl2溶液,混合后溶液中Ba2+ 浓度为________________mol/L。
【答案】H2A![]() H++HAHA
H++HAHA![]() H++A2 > c(Na+)>c(A2)>c(OH)>c(HA)>c(H+) 5.4×1010
H++A2 > c(Na+)>c(A2)>c(OH)>c(HA)>c(H+) 5.4×1010
【解析】
(1)存在的分子有H2O、H2A,则H2A为弱酸;
(2)等体积混合生成Na2A溶液,Na2A水解使溶液显碱性,离子水解以第一步为主;由反应式Ba2++A2-=BaA↓可知沉淀后A2-过量,计算溶液中c(A2-),再依据Ksp计算液中Ba2+ 浓度。
(1)溶液中存在H2A则说明H2A为弱电解质,所以电离方程式为:H2A![]() H++HA,HA
H++HA,HA![]() H++A2,故答案为:H2A
H++A2,故答案为:H2A![]() H++HA,HA
H++HA,HA![]() H++A2;
H++A2;
(2)10 mL 2 mol/L NaHA溶液与2 mol/L NaOH溶液等体积混合生成Na2A,Na2A在溶液中水解,溶液显碱性,pH>7,A2离子水解以第一步为主,则离子浓度关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故答案为:>;c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=![]() =1/3mol/L,根据BaA的Ksp=c(Ba2+)c(A2-)可得c(Ba2+)=
=1/3mol/L,根据BaA的Ksp=c(Ba2+)c(A2-)可得c(Ba2+)=![]() =5.4×10-10molL-1,故答案为: 5.4×10-10。
=5.4×10-10molL-1,故答案为: 5.4×10-10。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒温密闭容器中通入气体X并发生反应:2X(g)Y(g)(正反应放热),X的物质的量n(X)随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是

A.反应进行到a点时放出的热量多于反应进行到b点时放出的热量
B.实线表示使用催化剂的情形
C.b、c两点表明反应在相应的条件下达到了最大限度
D.反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A. 被氧化的砒霜为1.98 mg
B. 分解产生的氢气为 0.672 mL
C. 和砒霜反应的锌为3.90 mg
D. 生成砷化氢时,转移的电子总数为6×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() →Mn2++NO3-+H2O。下列叙述中正确的是( )
→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.![]() 中的粒子是OH-B.该反应中NO2-被还原
中的粒子是OH-B.该反应中NO2-被还原
C.反应过程中溶液的酸性增强D.生成1molNaNO3需消耗0.4molKMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=___________;用离子方程式表示FeCl3溶液用于净水的原因:______________________。
(2)已知NaHSO4在水中的电离方程式 NaHSO4 = Na++H++SO42-。在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢 钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7
(3)分析下表提供的数据:
化学式 | 电离常数 |
HClO | Ka=3×10-8 |
H2CO3 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
①84消毒液(有效成分为NaClO)久置于空气中会失效,写出发生反应的离子方程式: _____________________________________________
②判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
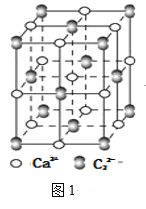
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是________。(填化学式)
(2)工艺师常用氢氟酸来雕刻玻璃,发生反应的化学方程式为_________。
(3)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,用氧化物形式表示为________。
(4)高纯度单晶硅可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
写出步骤①的化学方程式: _______。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃),提纯SiHCl3主要操作的名称是________。
步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外,还可能使产品中混有杂质________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com