
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是________。(填化学式)
(2)工艺师常用氢氟酸来雕刻玻璃,发生反应的化学方程式为_________。
(3)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,用氧化物形式表示为________。
(4)高纯度单晶硅可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
写出步骤①的化学方程式: _______。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃),提纯SiHCl3主要操作的名称是________。
步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外,还可能使产品中混有杂质________。
【答案】Si SiO2 4HF+SiO2=SiF4↑+2H2O Na2O·Al2O3·4SiO2 2C+SiO2![]() Si(粗)+2CO↑ 蒸馏 SiO2
Si(粗)+2CO↑ 蒸馏 SiO2
【解析】
(1)Si是半导体,可用于制造计算机芯片和太阳能电池,光导纤维的主要成分是SiO2;
(2)工艺师常用氢氟酸来雕刻玻璃,是因为氢氟酸能和SiO2反应,反应的化学方程式为4HF+SiO2=SiF4↑+2H2O;
(3)翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为Na2O·Al2O3·4SiO2;
(4)步骤①的化学方程式为2C+SiO2![]() Si(粗)+2CO↑;
Si(粗)+2CO↑;
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃),根据两者沸点不同,可采用蒸馏的方法分离;
步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外,产品中的Si会和O2在高温的条件下反应生成SiO2。


科目:高中化学 来源: 题型:
【题目】常温下,某溶液M中存在的离子有Na+、A2、HA、H+、OH,存在的分子有 H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:_____________________________________;
(2)若溶液M是由10 mL 2 mol/L NaHA溶液与2 mol/L NaOH溶液等体积混合而得到 的,则溶液M的pH__________7(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为_____________________________。已知Ksp(BaA)= 1.8×1010,向该混合溶液中加入10 mL 1 mol/L BaCl2溶液,混合后溶液中Ba2+ 浓度为________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、E的焰色反应均为黄色,其中B常用作食品的膨化剂,A与B按物质的量之比为1∶1混合并溶于足量水中,得到的溶液中只含有一种溶质。X为一种黑色固体单质,其氧化物参与大气循环,为温室气体。G为冶炼铁的原料,且为黑色晶体。G溶于盐酸中得到同种元素两种价态的化合物。A~H之间有如下的转化关系(部分物质未写出):

(1)写出下列物质的化学式:A___;C___;F___。
(2)在框图环境下,标准状况下得到11.2LD,则产生D的反应中,转移电子的物质的量为____mol。
(3)写出A+B→E的离子方程式:____。
(4)写出C和B混合加热过程中的全部化学方程式:___。
(5)写出D→G转化的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。

回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、S、H都是中学化学中常见的元素。按要求完成下列填空。
(1)0.5 mol CH4的质量为____________;标准状况下,4.48 L NH3所含分子数为___________。
(2)等物质的量的CH4、NH3和N2三种气体,所含原子数之比为__________,等质量的CH4和N2物质的量之比为__________。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为_______。
(4)在标准状况下,由SO2和CO2组成的混合气体为8.96 L,质量为24 g,该混合气体的平均摩尔质量是______,混合气体中CO2的体积分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
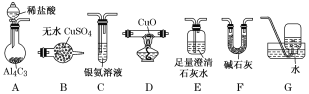
[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工业流程如下图.己知:①草酸钴晶体难溶于水②RH为有机物(难电离)。请回答下列问题:

(1)滤渣I的主要成分是_____(填化学式),写出一种能提高酸浸速率的措施_______。
(2)操作①用到的玻璃仪器有_______________。
(3)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式:_______________。
(4)加入氧化钴的目的是调节溶液的pH.若要将浸出液中Fe3+和Al3+全部沉淀,则应将浸出液的PH控制在_______。(已知:溶液中离子浓度小于1×10-5mol/L,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15, 1×10-38,1×10-32)
(5)加入(NH4)2C2O4反应的离子方程式为________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是____________。
(6)加入有机萃取剂的目的是__________。实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-)来测定溶液中C2O42-的浓度,KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果______(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. B的物质的量浓度 B. 混合气体的密度
C. 混合气体的压强 D. v(B消耗)=3v(D消耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com