
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
【答案】D
【解析】
A、由②、③可知, pH越小,+2价铁氧化速率越快,故A错误;
B、若pH>7,FeCl2变成Fe(OH)2,Fe(OH)2非常容易被氧化成Fe(OH)3,故B错误;
C、由①、③推测,升高温度,相同时间内+2价铁的氧化率增大,升高温度+2价铁的氧化速率加快,由图中数据不能判断反应的热效应,故C错误;
D、50℃、pH=2.5时,4 h内Fe2+的氧化率是60%,即消耗0.6a mol/L,4 h内平均消耗速率等于0.15a mol/(L·h),温度升高到60℃、pH=2.5时,+2价铁的氧化率速率加快,4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)。
正确答案选D。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变条件来改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
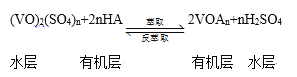
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解热镇痛药贝诺酯的合成路线如下:

请回答下列问题:
(1)水杨酸的系统命名____;阿斯匹林所含官能团的名称____,水杨酸(C)→阿司匹林(D)的反应类型为_____。
(2)扑热息痛的同分异构体中含有苯环,苯环上有两个取代基,氨基直接连在苯环上且属于酯类的有____种,写出任意一种同分异构体的结构简式___(任写一种)。
(3)F的结构简式为_________。
(4)生成贝诺酯的化学方程式为_________。
(5)已知上述B物质为苯酚钠。水杨酸的制备也可以以甲苯为原料制取,由甲苯为原料结合上述流程图合成水杨酸的合理流程图如下:
![]()
请回答下列问题:
试剂I为_____,试剂II为_____,物质Y为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.0 mol.L-1 的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
A. 适当升高温度 B. 加入NaOH固体
C. 通入NH3 D. 加入NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于试剂存放的叙述正确的是( )
A.硝酸银溶液存放在无色试剂瓶中
B.金属钠保存在CCl4中(钠的密度小于CCl4)
C.氢氧化钠溶液保存在带玻璃塞的玻璃瓶中
D.浓硫酸的装运包装箱应贴上如图所示的标识

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确的是( )

A. 该装置在太阳光下分解水,实现太阳能转化为化学能
B. 催化剂b附近溶液的pH增大
C. 催化剂a表面H2O发生还原反应,产生H2
D. 吸收1molSO2,理论上能产生1molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液M中存在的离子有Na+、A2、HA、H+、OH,存在的分子有 H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:_____________________________________;
(2)若溶液M是由10 mL 2 mol/L NaHA溶液与2 mol/L NaOH溶液等体积混合而得到 的,则溶液M的pH__________7(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为_____________________________。已知Ksp(BaA)= 1.8×1010,向该混合溶液中加入10 mL 1 mol/L BaCl2溶液,混合后溶液中Ba2+ 浓度为________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、E的焰色反应均为黄色,其中B常用作食品的膨化剂,A与B按物质的量之比为1∶1混合并溶于足量水中,得到的溶液中只含有一种溶质。X为一种黑色固体单质,其氧化物参与大气循环,为温室气体。G为冶炼铁的原料,且为黑色晶体。G溶于盐酸中得到同种元素两种价态的化合物。A~H之间有如下的转化关系(部分物质未写出):

(1)写出下列物质的化学式:A___;C___;F___。
(2)在框图环境下,标准状况下得到11.2LD,则产生D的反应中,转移电子的物质的量为____mol。
(3)写出A+B→E的离子方程式:____。
(4)写出C和B混合加热过程中的全部化学方程式:___。
(5)写出D→G转化的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com