
【题目】解热镇痛药贝诺酯的合成路线如下:

请回答下列问题:
(1)水杨酸的系统命名____;阿斯匹林所含官能团的名称____,水杨酸(C)→阿司匹林(D)的反应类型为_____。
(2)扑热息痛的同分异构体中含有苯环,苯环上有两个取代基,氨基直接连在苯环上且属于酯类的有____种,写出任意一种同分异构体的结构简式___(任写一种)。
(3)F的结构简式为_________。
(4)生成贝诺酯的化学方程式为_________。
(5)已知上述B物质为苯酚钠。水杨酸的制备也可以以甲苯为原料制取,由甲苯为原料结合上述流程图合成水杨酸的合理流程图如下:
![]()
请回答下列问题:
试剂I为_____,试剂II为_____,物质Y为____。
【答案】2-羟基苯甲酸 羧基、酯基 取代反应 9 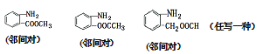
![]()
![]() Cl2 酸性KMnO4溶液
Cl2 酸性KMnO4溶液 ![]()
【解析】
苯与氯气反应生成的A为氯苯;已知B为苯酚钠,氯苯与NaOH发生卤代烃的水解生成苯酚钠;B在一定条件下生成2-羟基苯甲酸钠,2-羟基苯甲酸钠酸化变为水杨酸,水杨酸与乙酸酐发生取代反应生成阿司匹林;苯酚钠与一碘甲烷生成苯甲醚(E),E发生硝化反应在对位引入硝基;由扑热息痛的结构简式可逆推出F为对氨基苯酚。
(1)2-羟基苯甲酸钠酸化变为水杨酸,则水杨酸的结构简式为:![]() ,系统命名为2-羟基苯甲酸;阿司匹林的结构简式为:
,系统命名为2-羟基苯甲酸;阿司匹林的结构简式为:![]() ,含有的官能团为羧基和酯基;水杨酸(C)→阿司匹林(D)的反应类型为取代反应;
,含有的官能团为羧基和酯基;水杨酸(C)→阿司匹林(D)的反应类型为取代反应;
(2)扑热息痛的结构简式为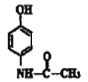 ,其同分异构体中含有苯环,苯环上有两个取代基,氨基直接连在苯环上且属于酯类,则一个取代基为-NH2,另一个为-OOCCH3,-CH2OOCH,-COOCH3,两个取代基在苯环上的位置有邻、间、对三种,符合条件的同分异构体有9种;如:
,其同分异构体中含有苯环,苯环上有两个取代基,氨基直接连在苯环上且属于酯类,则一个取代基为-NH2,另一个为-OOCCH3,-CH2OOCH,-COOCH3,两个取代基在苯环上的位置有邻、间、对三种,符合条件的同分异构体有9种;如:![]() 等;答案为:9;
等;答案为:9;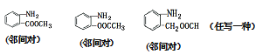 ;
;
(3)扑热息痛的结构简式为 ,F与乙酸取代反应生成扑热息痛,则F的结构简式为:
,F与乙酸取代反应生成扑热息痛,则F的结构简式为:![]() ;
;
(4)阿司匹林的结构简式为:![]() ,扑热息痛的结构简式为
,扑热息痛的结构简式为 ,两者发生酯化反应生成贝诺酯,反应的方程式为:
,两者发生酯化反应生成贝诺酯,反应的方程式为:![]() ;
;
(5)已知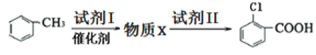 ,由于2—氯苯甲酸中氯原子和羧基处于邻位,所以应先是甲苯与Cl2发生取代反应生成2-氯甲苯,则试剂I为氯气;2-氯甲苯与试剂II反应生成2-氯苯甲酸(将甲基氧化成羧基),则试剂II为酸性高锰酸钾溶液;2-氯苯甲酸发生卤代烃的水解才能引入羟基,卤代烃的水解的条件为NaOH溶液,羧基、酚羟基与碱不能共存生成盐,则物质Y为
,由于2—氯苯甲酸中氯原子和羧基处于邻位,所以应先是甲苯与Cl2发生取代反应生成2-氯甲苯,则试剂I为氯气;2-氯甲苯与试剂II反应生成2-氯苯甲酸(将甲基氧化成羧基),则试剂II为酸性高锰酸钾溶液;2-氯苯甲酸发生卤代烃的水解才能引入羟基,卤代烃的水解的条件为NaOH溶液,羧基、酚羟基与碱不能共存生成盐,则物质Y为![]() ,答案为:Cl2;酸性KMnO4溶液;
,答案为:Cl2;酸性KMnO4溶液; ![]() ;
;


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
A. ①③⑤ B. ①③④ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组制备氢氧化铁胶体:洁净的小烧杯盛适量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol·L-1氯化铁溶液,至液体呈透明的红褐色。回答下列问题:
(1)氢氧化铁胶体中微粒直径的范围是________________。
(2)检验胶体制备成功的操作是__________________________________。
(3)实验中手不慎被玻璃割破,可用氯化铁溶液应急止血,主要原因是____________(填序号)。
①氯化铁溶液具有杀菌消毒的作用
②氯化铁溶液能使血液胶体凝固
③氯化铁溶液能产生氢氧化铁沉淀堵住伤口
④氯化铁溶液能使血液发生化学变化
(4)制备胶体的化学方程式为_______。如果将1molFeCl3全部制成胶体,胶粒数目______NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是

A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒温密闭容器中通入气体X并发生反应:2X(g)Y(g)(正反应放热),X的物质的量n(X)随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是

A.反应进行到a点时放出的热量多于反应进行到b点时放出的热量
B.实线表示使用催化剂的情形
C.b、c两点表明反应在相应的条件下达到了最大限度
D.反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
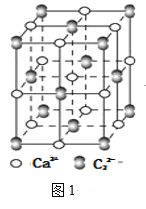
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com