
����Ŀ��ij��ѧС���Ʊ������������壺�ྻ��С�ձ�ʢ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ���1 mol��L��1�Ȼ�����Һ����Һ������ĺ��ɫ���ش��������⣺
(1)����������������ֱ���ķ�Χ��________________��
(2)���齺���Ʊ��ɹ��IJ�����__________________________________��
(3)ʵ�����ֲ������������ƣ������Ȼ�����ҺӦ��ֹѪ����Ҫԭ����____________(�����)��
���Ȼ�����Һ����ɱ������������
���Ȼ�����Һ��ʹѪҺ��������
���Ȼ�����Һ�ܲ�����������������ס�˿�
���Ȼ�����Һ��ʹѪҺ������ѧ�仯
(4)�Ʊ�����Ļ�ѧ����ʽΪ_______�������1molFeCl3ȫ���Ƴɽ��壬������Ŀ______NA(ѡ����ڡ������ڡ���С�ڡ�)��
���𰸡�1��100nm ��һ�������䣬�۲쵽һ��������ͨ· �� FeCl3+3H2O ![]() Fe(OH)3(����)+3HCl С��
Fe(OH)3(����)+3HCl ��
��������
������������Һ�Ĺؼ����ڣ���������ֱ����С��1nm��100nm���ѱ����Ȼ�����Һ�����ˮ�м���������У��õ����ɫ��Һ��Ϊ�����������壬�������������ܲ��������ЧӦ�������м���������Һ����ʹ�����۳��������Ϸ������н��
��1���������������ǽ����ɢϵ�е�һ�֣���������ֱ����С��1nm��100nm��
�ʴ��ǣ�1nm��100nm��
��2��������������Һ�Ĺؼ����ڣ���Һ����ֱ��С��1nm����������ֱ����С��1nm��100nm������Һ�����������ЧӦ�����������������ܲ��������ЧӦ����һ���������������������壬�ܲ���һ��������ͨ·��
�ʴ��ǣ���һ���������䣬�ܲ���һ��������ͨ·��
��3��ѪҺ���ڽ��壬�Ȼ�����Һ���ڵ������Һ������������Һ��FeCl3��Һ����ʹ�����۳���ѪҺ���۴ﵽֹѪЧ����
�ʴ�ѡ�ڣ�
��4���ѱ����Ȼ�����Һ�����ˮ�м���������У��õ����ɫ��Һ��Ϊ�����������壬�Ʊ�����Ļ�ѧ����ʽΪ��FeCl3+3H2O ![]() Fe(OH)3(����)+3HCl�����ڽ����Ǵ������ӵļ����壬��������1molFeCl3ȫ���Ƴɽ��壬������ĿС��NA��
Fe(OH)3(����)+3HCl�����ڽ����Ǵ������ӵļ����壬��������1molFeCl3ȫ���Ƴɽ��壬������ĿС��NA��
�ʴ��ǣ�FeCl3+3H2O ![]() Fe(OH)3(����)+3HCl��С�ڡ�
Fe(OH)3(����)+3HCl��С�ڡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ�����Ƿ��ȷ�Ӧ����
A. ����������ϡ����ķ�Ӧ
B. ���ȵ�ľ̿��![]() �ķ�Ӧ
�ķ�Ӧ
C. �����ڿ�����ȼ�յķ�Ӧ
D. ![]() ������
������![]() ����ķ�Ӧ
����ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������ڱ��еķֲ���ͼ��ʾ������Ϊ����Ԫ����ǽ���Ԫ�صķֽ��ߣ�������˵������ȷ����

A. Bֻ�ܵõ��ӣ�����ʧ����
B. ԭ�Ӱ뾶Ge��Si
C. As�����뵼�����
D. Po���ڵ������ڵ�VIA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ag++ SCN�� = AgSCN������ɫ����ijͬѧ̽��AgSCN���ܽ�ƽ�⼰ת������������ʵ�顣

����˵���У�����ȷ����
A. ����������˵��Ag+��SCN������AgSCN�����ķ�Ӧ����
B. �������������ԭ���Ƿ����˷�ӦFe(SCN)3 + 3Ag+ = 3AgSCN��+ Fe3+
C. ���в�����ɫ������������֤��AgI���ܽ�ȱ�AgSCN���ܽ��С
D. ���л�ɫ�����ܽ��ԭ�������AgI��KI��Һ�е�I-��һ�������˷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������V��Ϊ����Ԫ�أ����γɶ��̬�����ȫ��Һ�������һ�����͵���ɫ��������ϵͳ������ԭ������ͼ��

��֪��
�������� | VO2+ | VO2+ | V3+ | V2+ |
��ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
��1��ȫ��Һ����طŵ�ʱV2+����������Ӧ���õ�طŵ�ʱ�ܷ�Ӧʽ��_______
��2������ɴ���ʱ��������Һ����ɫ�� __________
��3�����ӽ���Ĥ��������_________
��4��������ˮ�����ˮ����Ⱦ���Ժ�����ˮ����VO2+�⣬����Fe3+�ȣ������ۺϴ�����ʵ�ַ���Դ�Ļ������ã��������£�

��֪��Һ����Բ�ͬ��Ԫ�صĴ�����ʽ��ͬ��
���Ļ��ϼ� | ���� | ���� |
+4�� | VO2+ | VO(OH)3- |
+5�� | VO2+ | VO43- |
����Һ�з�Ԫ�ص���Ҫ������ʽΪ_______
�������ڿ������ɻҰ�ɫת��Ϊ���ɫ���û�ѧ�����ʾ����NaOH�����ɳ����ķ�Ӧ����_______________��____________��
����ȡ������ȡ��ʵ�ַ��ķ�����������̿ɼ�ʾΪ��HAΪ�л���ȡ������
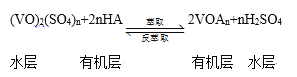
��ȡʱ��������������ԭ���� __________
�������������ε�ⷨ�������ַ��������ʣ���____����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����������͵����������ܱ������н��з�Ӧ��H2(g)��I2(g)![]() 2HI(g)(����Ӧ����)����Ӧ����5���Ӳ�õ⻯���Ũ��Ϊ0.5mol/L����������Ũ��Ϊ0.25mol/L������д���¿հף�
2HI(g)(����Ӧ����)����Ӧ����5���Ӳ�õ⻯���Ũ��Ϊ0.5mol/L����������Ũ��Ϊ0.25mol/L������д���¿հף�
��1��v(HI)=__��v(H2)=__��H2����ʼŨ��=__��
��2����������Ӧ�ﵽƽ��ʱ����ƽ��Ũ��c(HI)��c(I2)��c(H2)�Ĺ�ϵ��__(�������������2��1��1��������Ϊ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹҩ��ŵ���ĺϳ�·�����£�

��ش��������⣺
��1��ˮ�����ϵͳ����____����˹ƥ�����������ŵ�����____��ˮ���ᣨC������˾ƥ�֣�D���ķ�Ӧ����Ϊ_____��
��2������Ϣʹ��ͬ���칹���к��б�����������������ȡ����������ֱ�����ڱ������������������____�֣�д������һ��ͬ���칹��Ľṹ��ʽ___����дһ�֣���
��3��F�Ľṹ��ʽΪ_________��
��4�����ɱ�ŵ���Ļ�ѧ����ʽΪ_________��
��5����֪����B����Ϊ�����ơ�ˮ������Ʊ�Ҳ�����Լױ�Ϊԭ����ȡ���ɼױ�Ϊԭ�Ͻ����������ͼ�ϳ�ˮ����ĺ�������ͼ����:
![]()
��ش��������⣺
�Լ�IΪ_____���Լ�IIΪ_____������YΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Լ���ŵ�������ȷ���ǣ� ��
A.��������Һ�������ɫ�Լ�ƿ��
B.�����Ʊ�����CCl4��(�Ƶ��ܶ�С��CCl4)
C.����������Һ�����ڴ��������IJ���ƿ��
D.Ũ�����װ�˰�װ��Ӧ������ͼ��ʾ�ı�ʶ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ��ɽ�д�����ɽˮ�ֳ�����������о�NOx��SO2�ȴ�����Ⱦ������ƴ���������Ҫ���塣
(1)SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2��
��֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)= NH4HSO3(aq) ��H1=a kJ/mol��
��NH3��H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ��H2=b kJ/mol��
��2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ��H3=c kJ/mol��
��Ӧ2SO2(g)+4NH3��H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)����H=______kJ/mol��
(2)ȼú���糧�����÷�Ӧ2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ��H =681.8 kJ/mol��ú����������������SO2���ŷš����ڸ÷�Ӧ�����¶�ΪTKʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
2CaSO4(s)+2CO2(g) ��H =681.8 kJ/mol��ú����������������SO2���ŷš����ڸ÷�Ӧ�����¶�ΪTKʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ��/min Ũ��/mol��L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
��0��10 min�ڣ�ƽ����Ӧ����v(SO2)=_____mol/(L��min)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⡣�����ϱ��е������жϣ��ı������������_____������ĸ����
A��ͨ��һ������O2 B������һ�����ķ�״̼���
C���ʵ���С��������� D��������ʵĴ���
(3)NOx���ŷ���Ҫ����������β�����������÷�ӦC(s)+2NO(g)![]() N2(g)+CO2(g) ��H=34.0 kJ/mol���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��
N2(g)+CO2(g) ��H=34.0 kJ/mol���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��

��ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����{��������ԭ��Ϊ_______����1100Kʱ��CO2���������Ϊ______��
(4)��ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp������1050K��1.1��106 Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=____[��֪�������ѹ(P��)=������ѹ(P)���������]��
(5)����β���������÷�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=746.8 kJ/mol��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
N2(g)+2CO2(g) ��H=746.8 kJ/mol��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���____���>����<����=����k������ı�����
������1L���ܱ������г���1 molCO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����k���Uk��=_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com