
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
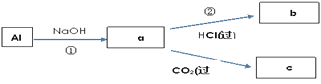
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
【答案】c b bc NaAlO2 AlCl3 Al(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ FeCl3 红 红褐
【解析】
(1)金属越活泼,与盐酸反应与剧烈,根据钠、铝、铁的活泼性分析判断;
(2)钠与水反应生成NaOH和氢气,且钠的密度比水的密度小,据此分析解答(2)和(3);
(4)由转化可知,①中Al与NaOH反应生成NaAlO2,②中NaAlO2与过量盐酸反应生成AlCl3,NaAlO2与过量二氧化碳反应生成Al(OH)3沉淀,据此分析解答;
(5)Fe跟Cl2反应生成氯化铁,溶液含铁离子,遇KSCN变为血红色,加NaOH生成红褐色沉淀,据此分析解答(5)和(6)。
(1)金属越活泼,与盐酸反应与剧烈,钠、铝、铁中钠最活泼,铁活泼性最差,与同浓度盐酸反应,反应最慢的是铁,故答案为:c;
(2)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:b;
(3)钠与水反应生成氢氧化钠和氢气,可观察到钠浮在水面上,熔成小球、小球四处游动,故答案为:bc;
(4)由上述分析可知,a、b、c分别为NaAlO2、AlCl3、Al(OH)3,反应①的离子方程式分别为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:NaAlO2;AlCl3;Al(OH)3;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)Fe跟Cl2在一定条件下反应生成氯化铁,化学式为FeCl3,故答案为:FeCl3;
(6)将FeCl3溶于水配成溶液,分装在两支试管中。a.若向其中一支试管中滴加KSCN溶液,溶液变成红色;b.向另一支试管中滴加NaOH溶液,反应生成红褐色的氢氧化铁沉淀,反应的离子方程式是Fe3++3OH-═Fe(OH)3↓,故答案为:红;红褐。


科目:高中化学 来源: 题型:
【题目】I.现有下列9种物质:①氧气;②二氧化硫;③稀硫酸;④铜;⑤氯化钡固体;⑥氢氧化钾固体;⑦硝酸钾溶液;⑧酒精(C2H5OH);⑨氧化钙固体,请将上述物质按要求完成下列问题(用相应化学式填空):
(1)属于酸性氧化物的有___________,属于电解质的是_______________________。
II.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(2)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是___________。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(3)写出制备Fe(OH)3胶体的化学方程式:__________________________。
(4)氢氧化铁胶体稳定存在的主要原因是______________(选填序号)。
A.胶体微粒直径小于1nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
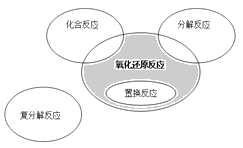
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )
A.4Fe(OH)2+O2+2H2O== Fe(OH)3
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4NH3+5O2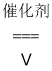 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
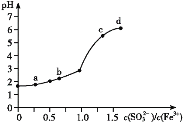
实验发现:
ⅰ.a点溶液澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ⅱ.c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。
下列分析合理的是
A.向a点溶液中滴加BaCl2溶液,无明显现象
B.b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O2Fe2++SO42-+2H+
C.c点溶液中发生的主要反应:2Fe3++3 SO32-+6H2O![]() 2Fe(OH)3+3H2SO3
2Fe(OH)3+3H2SO3
D.向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
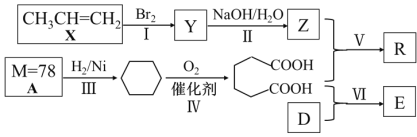
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3。请回答下列问题:
(1)Y的名称是____;Z的官能团名称是____;A的分子式是__________ ;
(2)反应Ⅳ的反应类型是_____;
(3)写出X发生加聚反应的化学方程式________;
(4)写出II反应的化学方程式_____________;
(5)写出Ⅵ反应的化学方程式___________;
(6)写出由Z和乙二酸在浓硫酸的作用下反应生成的一种六元环状化合物的键线式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.由2H和18O所组成的水11 g,其中所含的中子数为4NA
B.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
C.0.1 mol H3O+中含有的电子数为NA
D.标准状况下,1L乙醇完全燃烧产生CO2分子的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等量的Al分别加入0.3 L 1 mol·L-1的盐酸和NaOH溶液中,生成氢气的体积比为1∶2,则加入Al的质量为( )
A.2.7 gB.5.4 gC.8.1 gD.10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中,进行反应COS(g)+H2(g) H2S(g)+CO(g)。下列说法中能说明反应已达到平衡状态的是:
A. c(COS)保持不变B. c(H2S)=c(H2)
C. 容器中气体密度保持不变D. v(H2)=v(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com