
【题目】在恒温、恒容密闭容器中,进行反应COS(g)+H2(g) H2S(g)+CO(g)。下列说法中能说明反应已达到平衡状态的是:
A. c(COS)保持不变B. c(H2S)=c(H2)
C. 容器中气体密度保持不变D. v(H2)=v(H2S)
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
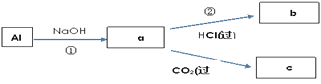
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:


下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl2和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+;②Fe2+和Fe3+; ③Fe2+和Cu2+; ④Cu2+和![]() .
.
A.②③B.②④C.①④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为___________________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
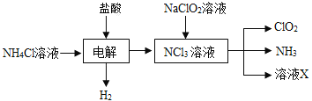
①电解时发生反应的化学方程式为_____________________________________。
②溶液X中大量存在的阴离子有_______________________________________。
③除去ClO2中的NH3可选用的试剂是______(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
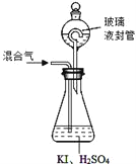
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_________________________________。
②玻璃液封装置的作用是 ______________。
③V中加入的指示剂通常为__________,滴定至终点的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
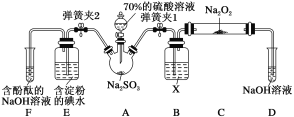
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸溶液至浸没三颈烧瓶中的固体。若将带火星的木条放在D试管口处,木条不复燃,说明SO2与Na2O2反应无O2生成,可能发生的化学方程式为____。
(2)关闭弹簧夹1,打开弹簧夹2,残余气体进入E、F中。E中的现象为___,E中反应的离子方程式为___。F中的现象为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“强酸性或强碱性溶液可使品红溶液褪色”。某兴趣小组探究SO2使品红溶液褪色的原因,实验如下。
Ⅰ.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中。观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a.0.1mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
d.pH=10 NaOH溶液 | 红色溶液不变色 | |
e.pH=2 H2SO4溶液 | 红色溶液不变色 |
(1)SO2水溶液中含![]() 的微粒有___。
的微粒有___。
(2)解释NaHSO3溶液显酸性的原因是___。
(3)实验d的目的是___。
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是___。
Ⅱ.探究褪色过程的可逆性
甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变。
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
(5)实验方案合理的是___(选填“甲”或“乙”)。结合离子方程式说明其原因是___。
(6)丙同学利用SO2的还原性设计并完成了下列实验:向a实验后的无色溶液中滴入过量___(填编号),使溶液最终恢复红色。也得出结论:该褪色过程是可逆的。
A.稀硝酸 B.氯水 C.双氧水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com