
【题目】在FeCl2和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+;②Fe2+和Fe3+; ③Fe2+和Cu2+; ④Cu2+和![]() .
.
A.②③B.②④C.①④D.①③
【答案】D
【解析】
由于Fe3+能氧化Fe、Cu,充分反应后滤去固体物质,固体为Cu或Fe、Cu,所以滤液中一定无Fe3+,可排除②④,固体物质存在两种可能:
1、当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+,故①正确;
2、当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;综上可知:滤液中一定含有Fe2+,故③正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
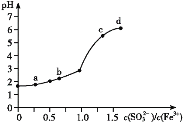
实验发现:
ⅰ.a点溶液澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ⅱ.c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。
下列分析合理的是
A.向a点溶液中滴加BaCl2溶液,无明显现象
B.b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O2Fe2++SO42-+2H+
C.c点溶液中发生的主要反应:2Fe3++3 SO32-+6H2O![]() 2Fe(OH)3+3H2SO3
2Fe(OH)3+3H2SO3
D.向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )

A. 二氧化硫和浓硫酸
B. 二氧化硫和碳酸氢钠溶液
C. 氯气和氢氧化钠溶液
D. 二氧化碳和氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:

(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________,反应类型:_______;
②_________________,反应类型:________。
(4)实验室怎样区分B和D?___________。
(5)除去F中少量B和D的最好试剂是________(填字母)。
A 饱和碳酸钠溶液 B 氢氧化钠溶液 C 苯 D 水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
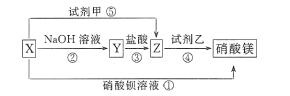
(1)根据上述转化关系,推断下列物质的化学式: X_____,Y_____,Z____,试剂甲____,试剂乙____。
(2)写出上述①~⑤步反应的离子方程式:
①____________________________________________。
②____________________________________________。
③____________________________________________。
④____________________________________________。
⑤____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中,进行反应COS(g)+H2(g) H2S(g)+CO(g)。下列说法中能说明反应已达到平衡状态的是:
A. c(COS)保持不变B. c(H2S)=c(H2)
C. 容器中气体密度保持不变D. v(H2)=v(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
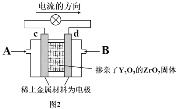
【题目】依据原电池原理,回答下列问题:
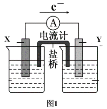
(1)图1是依据氧化还原反应:Zn +Cu 2+=Zn 2++Cu 设计的原电池装置。
①电极X的材料是_____(填化学名称),反应过程中电极X的现象是_______。
②Y电极发生的电极反应式为:_______。
(2)图2是使用固体电解质的燃料电池,该燃料电池总反应方程式为:CH4+2O2 =CO2+2H2O。装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e― = 2O2-)。
①c电极为____极。(填“正”或“负”)
②B物质为______。
③d电极上的电极反应式为_______。
④固体电解质中O2-离子移向_______电极。(填“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)难挥发性TaS2可采用如下装置提纯:将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中,反应如下:TaS2(s)+2I2(g)![]() TaI4(g)+S2(g),△H>0,下列说法正确的是:_____
TaI4(g)+S2(g),△H>0,下列说法正确的是:_____

A 在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
B 改变压强,平衡不发生移动,所以反应放出的热量不变
C 加入催化剂,改变了反应的途径,反应的△H也随之改变
D 向容器中加入更多的TaS2(s)可以提高I2(g)的转化率
(2)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中曲线所示。
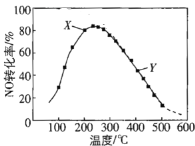
①下列说法不正确的是_____________。
A 反应2NO(g)+O2(g)![]() 2NO2(g),温度升高NO转化率增大说明正反应为吸热反应
2NO2(g),温度升高NO转化率增大说明正反应为吸热反应
B 图中X点所示条件下,延长反应时间能提高NO转化率
C 图中Y点所示条件下,增加O2的浓度能提高NO转化率
D 3800C下,C起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2000
②请在上图中画出不同温度下NO转化为NO2的平衡曲线_____。
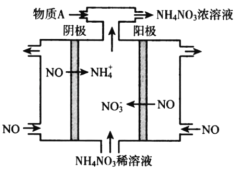
(3)电解NO可制备NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_________,写出电解过程的总反应化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com