
【题目】(1)①下列实验装置一般用于什么实验操作(填实验操作名称)
A __________ B ___________ C ___________
A.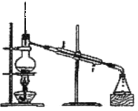 B.
B.![]() C.
C.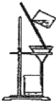
②将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是______。
(2)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的18.5倍,其中SO2的质量分数为 ________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为 ________。(小数点后保留1位)
(3)相同条件下,某Cl2与O2混合气体200 mL恰好与300 mL H2化合生成HCl和H2O(已知:H2+Cl2=2HCl),则混合气体中Cl2与O2的体积比为_____,混合气体的平均摩尔质量为_______________。(小数点后保留1位)
【答案】蒸馏 分液(或萃取分液) 过滤 q>2p 43.2% 37.8% 1:1 51.5 g·mol-1
【解析】
(1)①下列实验装置一般用于什么实验操作(填实验操作名称)
A .蒸馏 B.分液 C. 过滤
② 设3p%的硫酸密度为ρ1,p%的硫酸密度为ρ2,q%的稀硫酸密度为ρ3,
对硫酸来说,浓度越大,密度越大,所以ρ1>ρ2。设硫酸的体积都为1mL,则
q%=![]()
从而得出p、q的关系。
(2)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的18.5倍,则平均相对分子质量为18.5×2=37,因为CO、N2的相对分子质量都为28,所以我们把二者看成一种物质。设CO、N2的混合气的物质的量为x,SO2的物质的量为y,则
![]() ,
,![]() 。令CO、N2的混合气为3mol,则SO2为1mol。
。令CO、N2的混合气为3mol,则SO2为1mol。
SO2的质量分数为![]() 。若其中CO和N2的物质的量之比为1∶1,则CO、N2各为1.5mol,SO2为1mol,混合气体中氧元素的质量分数为
。若其中CO和N2的物质的量之比为1∶1,则CO、N2各为1.5mol,SO2为1mol,混合气体中氧元素的质量分数为![]() 。
。
(3)混合气发生两个反应:Cl2+H2=2HCl,2H2+O2=2H2O,相同条件下,某Cl2与O2混合气体200 mL恰好与300 mL H2化合生成HCl和H2O,列方程可求出Cl2与O2各为100mL,由此可求出混合气体中Cl2与O2的体积比,混合气体的平均摩尔质量为![]() 。
。
(1)① A .蒸馏;B.分液;C. 过滤;答案为:蒸馏;分液(或萃取分液);过滤;
② 设3p%的硫酸密度为ρ1,p%的硫酸密度为ρ2,q%的稀硫酸密度为ρ3,
对硫酸来说,浓度越大,密度越大,所以ρ1>ρ2。设硫酸的体积都为1mL,则
q%=。![]() 。答案为:q>2p;
。答案为:q>2p;
(2)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的18.5倍,则平均相对分子质量为18.5×2=37,因为CO、N2的相对分子质量都为28,所以我们把二者看成一种物质。设CO、N2的混合气的物质的量为x,SO2的物质的量为y,则
![]() ,
,![]() 。令CO、N2的混合气为3mol,则SO2为1mol。
。令CO、N2的混合气为3mol,则SO2为1mol。
SO2的质量分数为![]() 。若其中CO和N2的物质的量之比为1∶1,则CO、N2各为1.5mol,SO2为1mol,混合气体中氧元素的质量分数为
。若其中CO和N2的物质的量之比为1∶1,则CO、N2各为1.5mol,SO2为1mol,混合气体中氧元素的质量分数为 。答案为:43.2%;37.8%;
。答案为:43.2%;37.8%;
(3)混合气发生两个反应:Cl2+H2=2HCl,2H2+O2=2H2O,相同条件下,某Cl2与O2混合气体200 mL恰好与300 mL H2化合生成HCl和H2O,列方程可求出Cl2与O2各为100mL,由此可求出混合气体中Cl2与O2的体积比1:1,混合气体的平均摩尔质量为![]() 。答案为:1:1;51.5 g·mol-1。
。答案为:1:1;51.5 g·mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空(NA代表阿伏伽德罗常数的数值)。
(1)标准状况下 11.2L NH3 中含_______个氨分子。
(2)物质的量相等的SO2 和 SO3 所含的氧原子数目之比为__________。
(3)4.8g CH4 中所含氢原子的物质的量为______________。
(4)12.4 g Na2R 含 Na+0.4 mol,则 Na2R 的摩尔质量为为_________________。
(5)标况下,一定量的 N2 与 22.4L CO 所含的分子数相等,则 N2 的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
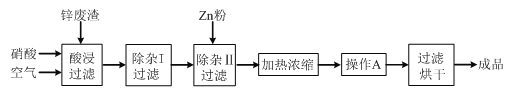
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是_____________________。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有_____。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为_____。检验Fe3+是否沉淀完全的实验操作是_____。
⑷加入Zn粉的作用是_____。“操作A”的名称是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。
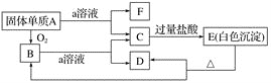
(1)写出各物质的化学式:
A.________、B________、C________、
D.________、E________、F________。
(2)B与a溶液反应的离子方程式是_________。
(3)A与a溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++![]() =BaSO4↓
=BaSO4↓
B.将NaHSO4溶液滴入Ba(OH)2溶液中至溶液呈中性:2H++![]() +2OH-+Ba2+=BaSO4↓+2H2O
+2OH-+Ba2+=BaSO4↓+2H2O
C.足量CO2通入澄清石灰水中:2OH-+CO2=H2O+![]()
D.碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2++![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的电子式是__________。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是_________。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是__________________________。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com