
【题目】有100mL K2SO4和Al2(SO4)3的混合溶液,已知其中含Al3+1.08 g,SO42-6.72 g,则该溶液中K+的浓度为
A.0.1 mol/LB.0.15 mol/L
C.0.2 mol/LD.0.25 mol/L
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8g H218O含有的中子数为NA
B. 0.1mol·L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA
C. 0.1mol 的CH4和NH3混合气体,含有的共价键数目为0.4NA
D. 4.6g Na与含0.1mol HCl的稀盐酸充分反应,转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是

A.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ mol-1
B.P4(s,白磷) = 4P(s,红磷) ΔH>0
C.白磷比红磷稳定
D.以上变化中,白磷和红磷所需活化能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
A![]() B
B![]() C
C![]() D。
D。
(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红,则A为____。写出A→B转化的化学方程式:______________。
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则C是______。A跟水发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
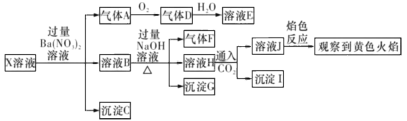
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
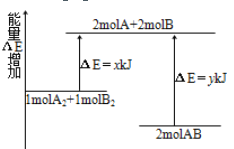
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.“抗坏血酸”维生素C具有还原性
B.杨万里《戏笔》中写道“野菊荒苔各铸钱,金黄铜绿两争妍”,铜绿的主要成分为碱式碳酸铜, Cu2(OH)2CO3属于碱式盐
C.向碳酸钠溶液中滴加稀盐酸,先不冒气泡,后冒气泡
D.食物腐败、钟乳石的形成、植物光合作用都与氧化还原反应有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com